
【题目】下图是元素周期表的一部分。

I.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为_________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。(用化学式表示)
(3)As的原子结构示意图为_______;其氢化物的化学式为_______。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_________,当消耗1mol还原剂时,电子转移了______mol。
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(5)A与水反应的化学方程式为_______________。
(6)工业上常用热还原法冶炼X,写出其化学方程式___________。
(7)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______________。
【答案】 Cl->O2->Na+ HClO4>H3PO4>H2CO3  AsH3 NaClO+2As+3H2O=2H3AsO4+NaCl 5 3NO2+H2O=2HNO3+NO Fe2O3+3CO
AsH3 NaClO+2As+3H2O=2H3AsO4+NaCl 5 3NO2+H2O=2HNO3+NO Fe2O3+3CO![]() 2Fe+3CO2 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H=-168Q/mkJ/mol
2Fe+3CO2 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H=-168Q/mkJ/mol
【解析】由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为N,⑥为O,⑦为P,⑧为Cl。
Ⅰ.(1)电子层多的离子半径大,具有相同电子层结构的离子,原子序数小的半径大,则②、⑥、⑧的离子半径为Clˉ>O2ˉ>Na+,故答案为:Clˉ>O2ˉ>Na+;
(2)非金属性Cl>P>C,则④、⑦、⑧的最高价含氧酸的酸性为HClO4>H3PO4>H2CO3,故答案为:HClO4>H3PO4>H2CO3;
(3)As的原子结构示意图为 ,最低价位-3价,则氢化物为AsH3,故答案为:
,最低价位-3价,则氢化物为AsH3,故答案为: ;AsH3;
;AsH3;
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂,Y为NaClO,与As的反应为5NaClO+2As+3H2O═2H3AsO4+5NaCl,As元素的化合价升高,为还原剂,则消耗1mol还原剂时转移电子为1mol×(5-0)=5mol,故答案为:5NaClO+2As+3H2O═2H3AsO4+5NaCl;5;Ⅱ.A为红棕色气体,B为强酸,X为常见金属单质,结合转化关系可知,A为NO2,H为HNO3,E为NO,X为Fe,C为Fe(NO3)3,D为Fe(NO3)2。
(5)A与水反应的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;(6)用热还原法冶炼X的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2,故答案为:Fe2O3+3CO
2Fe+3CO2,故答案为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(7)m克X与H2O反应放出QKJ(Q>O)的热量,则1molFe反应放出![]() kJ的热量,则热化学方程式为3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ的热量,则热化学方程式为3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-![]() kJ/mol,故答案为:3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-
kJ/mol,故答案为:3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-![]() kJ/mol。
kJ/mol。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水.当生成1mol Zn(NO3)2时,消耗的硝酸的物质的量为( )
A.2mol
B.1mol
C.2.25 mol
D.2.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的腐蚀与防护的说法中,不正确的是
A. 温度越高,金属腐蚀速率越快
B. 在铁管外壁上镀锌可防止其被腐蚀
C. 金属被腐蚀的本质是金属发生了氧化反应
D. 将钢闸门与直流电源的正极相连可防止其被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。

①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
ⅰ | 150 |
| 0.1 |
ⅱ | ________ | ________ | 5 |
ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类最初使用的有机物大多源自于自然界,从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

(1)甲中含氧官能团的名称为______,甲分子中处于同一平面的碳原子数量最多为___个。
(2)由甲转化为乙需经下列过程(己略去各步反应的无关产物,下同):

其中反应I的反应类型为______,反应Ⅱ的化学方程式为(注明反应条件)________。
(3)己知:RCHCHR![]() RCHO+RCHO;2HCHO
RCHO+RCHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
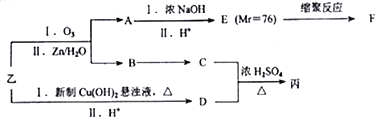
① 下列物质不能与C反应的是______(选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式_____。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
③ 写出乙与新制氢氧化铜悬浊液反应化学方程式________。
④ 写出F的结构简式_________。
⑥ 写出C和D反应生成丙的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1mol/LHR溶液中逐滴滴入0.1mol/L的氨水,所得溶液pH 及导电能力与加入氨水体积的关系如图。下列说法不正确的是

A. 常温下,电离平衡常数 Ka(HR)≈Kb(NH3 H2O)
B. b点溶液pH=7,此时HR溶液与氨水恰好完全反应
C. c 点溶液中存在 c(NH4+ )>c(R- )>c(OH- )>c(H+)
D.a、b、c三点中,c点NH3 H2O的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:2Na+2H2O===2Na++2OH-+H2↑
D.铝跟氢氧化钠溶液反应: 2Al+2OH-+2H2O=2AlO2-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com