
【题目】碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为________,其溶于水能_____水的电离(填“促进”或“抑制”),且使溶液的pH_______(填“升高”“降低”或“不变”),原因是_________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2![]() 4NO+6H2O(g) △H=-905kJ/mol ①
4NO+6H2O(g) △H=-905kJ/mol ①
4NH3(g)+3O2![]() 2N2+6H2O(g) △H=-1268kJ/mol ②
2N2+6H2O(g) △H=-1268kJ/mol ②
①氮气与氧气反应生成NO的热化学方程式为______________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是_____。

A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间
B.工业上采用物料比![]() 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则M的化学式为_______。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1molM,则电路中通过_____mol电子。
【答案】 1∶3 减小 提高 正向 Al(NO3)3 促进 降低 Al3++3H2O![]() Al(OH)3+3H+ N2(g)+O2(g)2NO(g) ΔH=+181.5 kJ·mol1 AD CH3OH 6
Al(OH)3+3H+ N2(g)+O2(g)2NO(g) ΔH=+181.5 kJ·mol1 AD CH3OH 6
【解析】(1)在密闭容器内(反应过程保持体积不变),使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。氮气和氢气按照化学计量数之比充入进行反应,所以当反应达到平衡时,N2和H2的浓度之比是1∶3;正反应放热,升高平衡体系的温度,平衡向逆反应方向进行,混合气体的物质的量增加,总质量不变,则混合气体的平均式量减小;当达到平衡时,再向容器内充入1mol N2,平衡向正反应方向进行,所以H2的转化率提高;当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,平衡正向移动;(2)由碳、氮、氧、铝元素中的三种组成的某种强酸弱碱盐是硝酸铝,化学式为Al(NO3)3,铝离子水解溶液显酸性,即其溶于水能促进水的电离,溶液的pH降低,水解方程式为Al3++3H2O
2NH3(g) △H=-92.4kJ/mol。氮气和氢气按照化学计量数之比充入进行反应,所以当反应达到平衡时,N2和H2的浓度之比是1∶3;正反应放热,升高平衡体系的温度,平衡向逆反应方向进行,混合气体的物质的量增加,总质量不变,则混合气体的平均式量减小;当达到平衡时,再向容器内充入1mol N2,平衡向正反应方向进行,所以H2的转化率提高;当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,相当于增大压强,平衡正向移动;(2)由碳、氮、氧、铝元素中的三种组成的某种强酸弱碱盐是硝酸铝,化学式为Al(NO3)3,铝离子水解溶液显酸性,即其溶于水能促进水的电离,溶液的pH降低,水解方程式为Al3++3H2O![]() Al(OH)3+3H+;(3)①已知:①、4NH3(g)+5O2
Al(OH)3+3H+;(3)①已知:①、4NH3(g)+5O2![]() 4NO+6H2O(g) △H=-905kJ/mol,②4NH3(g)+3O2
4NO+6H2O(g) △H=-905kJ/mol,②4NH3(g)+3O2![]() 2N2+6H2O(g) △H=-1268kJ/mol,根据盖斯定律可知(①-②)÷2即得到氮气与氧气反应生成NO的热化学方程式:N2(g)+O2(g)=2NO(g) ΔH=+181.5 kJ·mol1;②A、根据图像可知780~840℃之间生成的NO含量最高,所以工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间,A正确;B、工业上采用物料比
2N2+6H2O(g) △H=-1268kJ/mol,根据盖斯定律可知(①-②)÷2即得到氮气与氧气反应生成NO的热化学方程式:N2(g)+O2(g)=2NO(g) ΔH=+181.5 kJ·mol1;②A、根据图像可知780~840℃之间生成的NO含量最高,所以工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间,A正确;B、工业上采用物料比![]() 在1.7~2.0,主要是为了氨气的转化率,生成更多的NO,B错误;C、正反应体积增大,加压平衡向逆反应方向进行,NH3生成NO的转化率降低,C错误;D、由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低,D正确,答案选AD;(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则根据原子守恒可知M的化学式为 CH3OH;甲醇中碳元素是-2价,反应后转化为CO2,升高到+4价,失去6个电子,所以电池工作时消耗1molM,则电路中通过6mol电子。
在1.7~2.0,主要是为了氨气的转化率,生成更多的NO,B错误;C、正反应体积增大,加压平衡向逆反应方向进行,NH3生成NO的转化率降低,C错误;D、由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低,D正确,答案选AD;(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则根据原子守恒可知M的化学式为 CH3OH;甲醇中碳元素是-2价,反应后转化为CO2,升高到+4价,失去6个电子,所以电池工作时消耗1molM,则电路中通过6mol电子。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
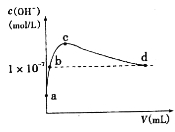
A.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙醇难溶于水 B. 乙烯可使酸性KMnO4溶液褪色
C. 乙酸的酸性比碳酸弱 D. 苯不能萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水.当生成1mol Zn(NO3)2时,消耗的硝酸的物质的量为( )
A.2mol
B.1mol
C.2.25 mol
D.2.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有A.酸性 B.强氧化性 C.高沸点、难挥发 D.脱水性 E.吸水性等性质.以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入横线上.①热的浓硫酸与铜反应.
②加热条件下浓硫酸和木炭反应.
③浓硫酸和生石灰反应.
④浓硫酸干燥H2、O2 等气体. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.K+、MnO4-、Na+、Cl- B.Na+、H+、NO3-、SO42-
C.Fe3+、Na+、Cl-、SO42- D.K+、Na+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类最初使用的有机物大多源自于自然界,从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

(1)甲中含氧官能团的名称为______,甲分子中处于同一平面的碳原子数量最多为___个。
(2)由甲转化为乙需经下列过程(己略去各步反应的无关产物,下同):

其中反应I的反应类型为______,反应Ⅱ的化学方程式为(注明反应条件)________。
(3)己知:RCHCHR![]() RCHO+RCHO;2HCHO
RCHO+RCHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
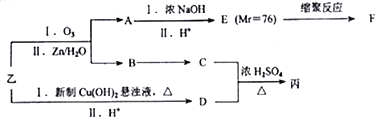
① 下列物质不能与C反应的是______(选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式_____。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
③ 写出乙与新制氢氧化铜悬浊液反应化学方程式________。
④ 写出F的结构简式_________。
⑥ 写出C和D反应生成丙的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com