
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_______________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)=CH3OH(g) △H 。在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图。

①在上图A、B、C三点中,选填下表物理且对应最大的点。
反应速率 | 平衡常数K | 平衡转化率a |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,该反应向_________方向进行(城“正反应”、‘逆反应”或“不移动”)。
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系如图所示,测得D点氢气的转化率为40%,则x=_____________。

(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[ c(Fe3+)≤4×l0-19]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38〕
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓NaOH 溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如下图所示。

则A溶液中溶质的成分为___________________(填化学式);阳极的电极反应式为_____________
【答案】 Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g)△H=-23.5 kJ![]() mol-1 C AB A 正反应 3 3 ≤ pH ≤ 5 NaOH Fe- 6e- + 8OH- = FeO42- + 4H2O
mol-1 C AB A 正反应 3 3 ≤ pH ≤ 5 NaOH Fe- 6e- + 8OH- = FeO42- + 4H2O
【解析】(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol ,③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol,根据盖斯定律由①×![]() -②×
-②×![]() -③×
-③×![]() 可得Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g),则△H=(-393.5kJ/mol)×
可得Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g),则△H=(-393.5kJ/mol)×![]() -(+172.5kJ/mol)×
-(+172.5kJ/mol)×![]() -(-1651.0kJ/mol)×
-(-1651.0kJ/mol)×![]() =-23.5 kJ
=-23.5 kJ![]() mol-1 ,故
mol-1 ,故
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-23.5 kJ![]() mol-1 ;
mol-1 ;
(2)①由图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,温度越高反应速率越快,反应速率最高的为C点,温度升高平衡逆向移动,则化学平衡常数减小,则AB点平衡常数相等且大于C点;温度高反应物的转化率降低,压强增大反应物的转化率升高,则A点为低温高压,故A点转化率最高;
② CO(g)+2H2(g)=CH3OH(g)
起始时(mol)1 2 0
变化(mol) 0.5 1 0.5
平衡(mol) 0.5 1 0.5
现在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,相当于恒容条件下将两个平衡状态相加,平衡向体积减小的方向进行,即正向进行;
③D点时H2的转化率为40%,CO的转化率为60%,设起始时H2为amol,变化量为0.4amol,CO超始量为bmol,变化量为0.6bmol,则0.4amol:0.6bmol=2:1,则a:b=3:1,则x=[n(H2)/n(CO)]=a:b=3:1=3;
(3)根据KspFe(OH)3=4×l0-38,当Fe3+完全沉淀[ c(Fe3+)≤4×l0-5]时c(OH-)=![]() =10-11mol/L,此时溶液pH=3,当Cu2+开始沉淀时,根据KspCu(OH)2=2.6×l0-19,c(OH-)=
=10-11mol/L,此时溶液pH=3,当Cu2+开始沉淀时,根据KspCu(OH)2=2.6×l0-19,c(OH-)=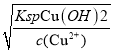 =10-9mol/L,此时溶液pH=5,则需控制溶液pH的范围为3 ≤ pH ≤ 5 ;
=10-9mol/L,此时溶液pH=5,则需控制溶液pH的范围为3 ≤ pH ≤ 5 ;
(4)电解池的左侧连接电源负极为阴极,电解池工作时阴极发生还原反应,溶液中的H+(来源于水的电离)生成H2,促进水的电离产物大量OH-,OH-不能透过阳离子交换膜进入阳极室,则A流出的溶液为NaOH;阳极发生氧化反应,Fe失电子在碱性条件下被氧化为FeO42-,电极反应式为Fe- 6e- + 8OH- = FeO42- + 4H2O。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】人类最初使用的有机物大多源自于自然界,从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

(1)甲中含氧官能团的名称为______,甲分子中处于同一平面的碳原子数量最多为___个。
(2)由甲转化为乙需经下列过程(己略去各步反应的无关产物,下同):

其中反应I的反应类型为______,反应Ⅱ的化学方程式为(注明反应条件)________。
(3)己知:RCHCHR![]() RCHO+RCHO;2HCHO
RCHO+RCHO;2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
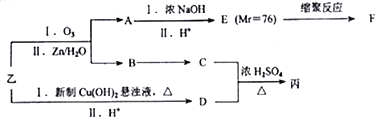
① 下列物质不能与C反应的是______(选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式_____。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
③ 写出乙与新制氢氧化铜悬浊液反应化学方程式________。
④ 写出F的结构简式_________。
⑥ 写出C和D反应生成丙的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期主族元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素,请回答:
(1)D在元素周期表中的位置是____________。
(2)C2B2的电子式是____________;
(3)B、C、E的离子半径由大到小的顺序为_________________(用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为________。
<span style="font-size: 14px; font-family: "Times New Roman";"><span contenteditable="true">(4)</span></span>B的氢化物比同主族的氢化物的熔沸点明显偏高的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:2Na+2H2O===2Na++2OH-+H2↑
D.铝跟氢氧化钠溶液反应: 2Al+2OH-+2H2O=2AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是
A. 锂比能量(单位质量的电极材料放出电能的大小)大,可用作电池负极
B. 浓硫酸具有脱水性,可用于干燥氯气
C. (NH4)2SO4浓溶液使蛋白质溶液发生盐析,可用于杀菌消毒
D. 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X+Y=M+N为吸热反应,对该反应的下列说法中正确的是
A. X的能量一定低于M B. Y的能量一定低于N
C. X和Y的总能量一定低于M和N的总能量 D. 因为该反应为吸热反应,故必须加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
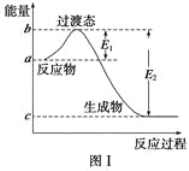
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 24g金属镁变为镁离子时失去的电子数为NA
B. 18g水所含的电子数目为NA
C. 在常温常压下11.2L二氧化硫所含的分子数目为0.5NA
D. 在常温常压下32g氧气所含的原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com