
【题目】25℃时,取浓度均为0.1mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。

下列说法正确的是
A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
【答案】D
【解析】
A.曲线I滴定前溶液的pH大于7,为盐酸滴定氨水,当滴加溶液到10 mL时,溶液中含有等浓度的NH3H2O和NH4Cl,不含CH3COO,A错误;
B.曲线I中滴加溶液到25 mL时,溶液含NH4Cl和少量的HCl,离子浓度大小顺序为:c(C1-) > c(NH4+)>c(H+)>c(OH-),B错误;
C.曲线II滴定前溶液的pH小于7,为NaOH溶液滴定醋酸,溶液不存在NH4+和Cl,C错误;
D.曲线II中滴加溶液到10mL时,溶液含有等浓度的CH3COOH和CH3COONa,根据电荷守恒可得:c(CH3COO)+c(OH)=c(Na+)+c(H+),根据物料守恒可得:c(CH3COOH)+c(CH3COO)=2c(Na+),①式×2—②式可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+ O2(g)=2H2O(l) ΔH1=-572 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 242 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶2B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的实验操作,不能实现相应实验目的的是
A.鉴别甲苯与己烷 | B.实验室制备乙酸乙酯 | C.检验电石与饱和食盐水的产物乙炔 | D. 比较乙酸、碳酸与苯酚酸性强弱 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
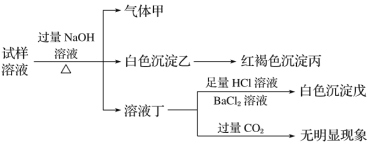
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物键线式的特点是以线表示键,每个拐点和端点均表示有一个碳原子,并以氢原子补足四价,C、H不表示出来,某有机化合物的立体结构如图所示。

(1)写出该有机化合物的分子式____。
(2)该有机化合物属于___。
A.环烷烃 B.饱和烃
C.不饱和烃 D.芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明亚硝酸是弱电解质的是
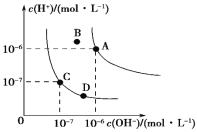
①亚硝酸溶液中存在HNO2分子,呈酸性
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1 mol·L-1 HNO2溶液中,c(H+)=0.015 mol·L-1
⑤向水中加入亚硝酸钠固体,如图水的电离平衡曲线可以从C点到D点
A.①②③B.②③④C.①②④⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 ![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为____________。
(2)装置B中的试剂是____________,若撤去装置B,可能导致装置D中副产物____________(填化学式)的量增加;装置D可采用____________加热的方法以控制反应温度在70℃左右。
(3)装置中球形冷凝管的作用为____________,写出E中所有可能发生的无机反应的离子方程式____________。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行____________。
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000molL-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O溶液20.00mL。则产品的纯度为____________(计算结果保留三位有效数字)。
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是____________
a.分别测定0.1molL-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1molL-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com