
【题目】室温下,将0.10molL﹣1的盐酸滴入20mL0.10molL﹣1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=﹣lg c(OH﹣),下列说法正确的是( ) 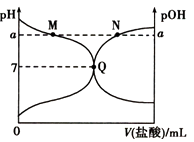
A.M点所示的溶液中c(NH4+)+c(NH3H2O)=c(Cl﹣)
B.Q点所示的溶液中c(NH4+)>c(Cl﹣)>c(H+)=c(OH﹣)
C.N点所示的溶液中c(NH4+)=c(Cl﹣)
D.M点和N点所示的溶液中水的电离程度相同
【答案】D
【解析】解:由于Kw=(H+)×c(OH﹣)=10﹣14,则溶液的pH+pOH=14,实线为pH曲线,虚线为pOH曲线,作垂直体积坐标轴线与pH曲线、pOH曲线交点为相应溶液中pH、pOH.Q点的pH=pOH,则Q点溶液呈中性,
A.M点溶液呈碱性,为NH4Cl、NH3H2O混合溶液,溶液中c(NH4+)+c(NH3H2O)>c(Cl﹣),故A错误;
B.Q点溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知:c(NH4+)=c(Cl﹣),正确的离子浓度大小为:c(NH4+)=c(Cl﹣)>c(H+)=c(OH﹣),故B错误;
C.N点溶液呈酸性,溶液中(H+)>c(OH﹣),结合电荷守恒c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),可知c(NH4+)<c(Cl﹣),故C错误;
D.M点溶液中氢离子源于水的电离,N点氢氧根离子源于水的电离,而M点氢离子浓度与N点氢氧根离子浓度相等,则M、N点所示溶液中水的电离程度相同,故D正确;
故选D.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种仪器装置的用法,不合理的是
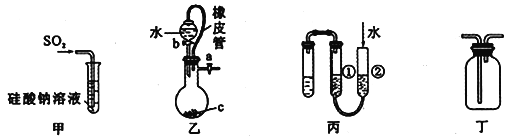
A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应热和焓变的单位都是 kJ
B.相同条件下,生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
C.在任何条件下,化学反应的焓变都等于化学反应的反应热
D.任何化学反应的反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能为( )
①x+2 ②x+4 ③x+16 ④x+26 ⑤x+32
A.①⑤B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前4min的平均反应速率υ(Z)=0.0125 molL﹣1min﹣1
B.其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( ) 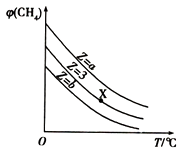
A.该反应的焓变△H<0
B.图中Z的大小为a<3<b
C.图中X点对应的平衡混合物中 ![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
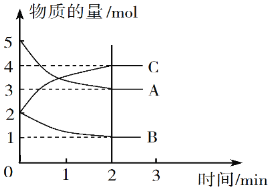
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com