研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
(1)将体积比为1:1的NO和NO
2的混合气通入氢氧化钠溶液,气体被完全吸收,生成水和一种盐,有关反应的离子方程式为
.汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质.
已知:N
2(g)+O
2(g)=2NO(g)△H=+180.5kJ?mol
-12C(s)+O
2(g)=2CO(g)△H=-221.0kJ?mol
-1C(s)+O
2(g)=CO
2(g)△H=-393.5kJ?mol
-1则反应2NO(g)+2CO(g)=N
2(g)+2CO
2(g)的△H=
kJ?mol
-1(2)NO
2与SO
2混合可发生反应:NO
2(g)+SO
2(g)═SO
3(g)+NO(g).
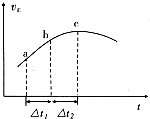
①将一定量的NO
2与SO
2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是
(填字母).
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t
1=△t
2时,SO
2的消耗量:a~b段大于b~c段
②在一定温度下,将物质的量比为1:2的NO
2与SO
2置于固定容积的密闭容器中发生上述反应,测得平衡时NO
2与SO
2物质的量比为1:6,则该温度下的平衡常数K=
.
(3)CO在实际中有以下应用:
①用Li
2CO
3和Na
2CO
3熔融盐混合物作电解质,CO为负极燃气,空气与CO
2的混合气作为正极助燃气,制得在650℃下工作的燃料电池.完成有关的电极反应式.
负极反应式:2CO+2CO
32-一4e
-=4CO
2正极反应式:
.
②1mol CO和1mol H
2O(g)在一定条件下反应达到平衡状态时,生成0.67molCO
2,若在相同条件下将H
2O(g)改为4mol,反应达平衡时,生成CO
2的物质的量约为
(填字母).
A.0.52mol B.1.4mol C.2mol D.0.94mol.

 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.


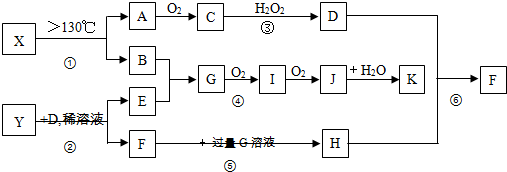

 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: