
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
| C、c(NH3?H2O) | ||||
| D、n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B、常温下能用铝制容器盛放浓硫酸 |
| C、浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
| D、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液腐蚀铜制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| B、漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、向碘化钾溶液中通入臭氧:O3+2I一+3H2O═6OH-+I2 |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
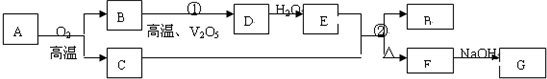
查看答案和解析>>
科目:高中化学 来源: 题型:
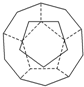 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.查看答案和解析>>
科目:高中化学 来源: 题型:
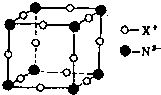 氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.
氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 |
 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com