
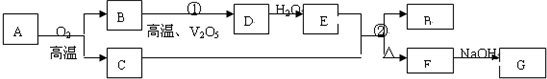
| ||
| ||
| ||
| ||
| △ |
| 0.122 |
| 0.112×0.05 |
| ||
| △ |
| 0.12 |
| 0.11+0.05+0.12 |
| 0.12+2x |
| 0.11+0.55-x |
| 0.23 |
| 0.605 |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
| A、氯气难溶于饱和食盐水 |
| B、用加压的方法促进CO2在水中的溶解 |
| C、FeCl3+3KSCN?Fe(SCN)3+KCl,向体系中加入KCl固体 |
| D、合成氨工业中,及时将氨气液化移出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
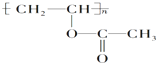 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A、1mol该有机物与NaOH溶液完全反应时,消耗NaOH 1mol |
| B、该有机物水解所得产物能发生取代反应 |
| C、该有机物可通过加聚反应生成 |
| D、该有机物的单体只有一种且能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
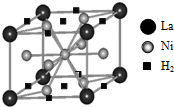 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com