
| 1 |
| 2 |
| 1 |
| 2 |
| 571.6KJ/mol |
| 2 |


科目:高中化学 来源: 题型:
| A、硫元素的质量比为1:1 |
| B、氧元素的质量比为6:5 |
| C、电子总数之比为1:1 |
| D、物质的量之比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液腐蚀铜制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| B、漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、向碘化钾溶液中通入臭氧:O3+2I一+3H2O═6OH-+I2 |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
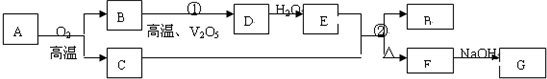
查看答案和解析>>
科目:高中化学 来源: 题型:
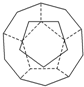 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.查看答案和解析>>
科目:高中化学 来源: 题型:
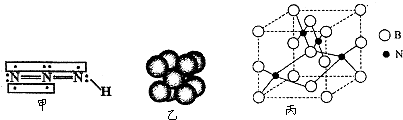
查看答案和解析>>
科目:高中化学 来源: 题型:
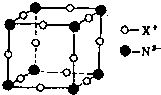 氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.
氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4+Cl2
| |||
B、CH3Cl+Cl2
| |||
C、CH3OH+HCl
| |||
D、CH2=CH2+H2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com