
【题目】下列化学用语正确的是
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42-
2NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D. NaHSO3在水中的电离:HSO3- + H3O+![]() SO32-+ H2O
SO32-+ H2O
【答案】B
【解析】
A. (NH4)2Fe(SO4)2属于可溶于水的强电解质,在水溶液中完全电离,电离方程式中用“=”连接:(NH4)2Fe(SO4)2=2NH4+ + Fe2 + + 2SO42-,A项错误;
B.Al(OH)3属于弱电解质,在水中只能部分电离,电离方程式正确;B项正确;
C.H3PO4属于多元弱酸,是弱电解质,溶解于水时分步电离:H3PO4![]() H2PO4-+H+,H2PO4-
H2PO4-+H+,H2PO4-![]() HPO42-+H+,HPO42-
HPO42-+H+,HPO42-![]() PO43-+H+,C项错误;
PO43-+H+,C项错误;
D.NaHSO3是强电解质,在水中的电离方程式应为:NaHSO3=Na++HSO3-,HSO3-![]() SO32-+H+,D项错误;答案选B。
SO32-+H+,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
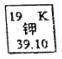
【题目】如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________。
某化学兴趣小组欲除去16g固体氯化钠中混有的少量氯化钙和硫酸镁杂质,设计实验方案如下(已知常温下NaCl的溶解度为36g/100g![]() O)
O)

(1)加水溶解时,适合的取水量为________
A. 20mL B. 45mL C. 75mL D. 100mL
(2)为加快溶解速率,可采取的方法是________和________(任写2种)
(3)依次加入的过量试剂为________、________和________。
(4)溶液A中加入的适量酸为________,若该酸也加过量,对所得到氯化钠的纯度________(填“有”或“没有”)影响
(5)操作Ⅰ的名称是________;操作II的名称是________。两种操作中都用到的玻璃仪器是________。
(6)最后得到的固体氯化钠与原固体混合物中的氯化钠质量相比,结果________(填“增大”、“减小”或“不变”)。
(7)固体A中所含的盐的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是工业生产上的氯化氢合成塔,请写出各处物质的化学式:
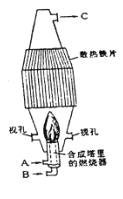
(1)B________,C________。
(2)工业上制备HC1的化学方程式是____________。
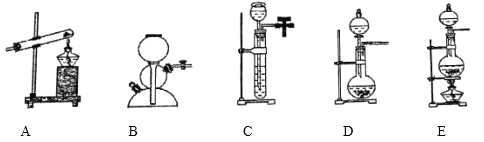
(3)实验室常用NaCl和浓硫酸起反应制取氯化氢,当微热时,发生装置应选用下列装置的________(填编号)
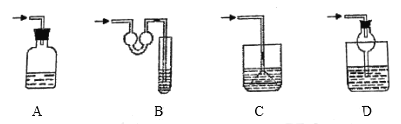
(4)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的是________。
(5)图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(6)该浓盐酸中HC1的物质的量浓度为________mol/L.
(7)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是________
A.溶液中HC1的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(8)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.40mol/L的稀盐酸。该学生需要量取________mL上述浓盐酸进行配制。
(9)下列操作中,使溶液的浓度偏低的操作是________
A.摇匀后,液面稍低于刻度线,再加水使之相平
B.转移时,有少量溶液洒到实验桌上
C.溶液转移前,容量瓶中已经有少量蒸馏水
D.定容时,不小心加水超过了刻度线,趁还未摇匀,立刻吸出多余的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com