
【题目】K层有_____________个能级,用符号表示为_____________;L层有_____________个目自级,用符号表示为_____________;M层有_____________个能级,用符号表示为_____________。由此可推知第n(n为正整数)电子层最多可能有_____________个能级,当![]() 时,能量最低的两个能级的符号分别为_____________,它们的原子轨道形状分别为_____________、_____________。
时,能量最低的两个能级的符号分别为_____________,它们的原子轨道形状分别为_____________、_____________。
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为![]() ],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法正确的是( )
],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法正确的是( )
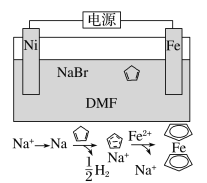
A.该电池工作是,镍连接的是电源的正极
B.可将该电池的DMF惰性有机溶剂更换为NaOH溶液
C.该反应的总反应方程式为Fe+2![]() +H2↑
+H2↑
D.溶液中的Na+离子不断的向Fe附近移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
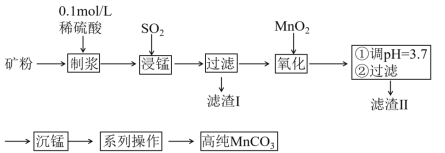
(1)对矿石进行粉粹的目的是_______;
(2)滤渣Ⅰ、Ⅱ分别为________、________;
(3)采用1%稀硫酸而不采用水混合矿粉制浆的原因是_________;不采用较浓H2SO4的原因是______;不直接采用H2SO4浸锰的原因是___________。
(4)浸锰的离子方程式为____________;
(5)“系列操作”为过滤、_________、干燥。
(6)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓溶液吸收,得到白色沉淀19.7g,则所得产品的纯度为________%(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
A.x+y<z
B.平衡向正反应方向移动
C.A的转化率降低
D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1AlCl3溶液中含有的Al3+数目小于NA
B.标准状况下,11 g 3H216O中含有的质子数目为6NA
C.1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D.常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能是指处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量。如图是部分元素的第一电离能I1随原子序数变化的曲线图。
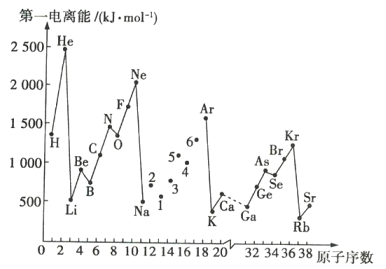
请回答下列问题:
(1)分析图中同周期元素第一电离能的变化规律,将Na~Ar之间1~6号元素用短线连接起来,构成完整的图象___。
(2)根据图分析可知,同主族元素的第一电离能的变化规律是___。
(3)图中5号元素在元素周期表中的位置是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:

(1)从“除质2”后的溶液中得到MnSO4的操作为______、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①__________;②__________。提高软锰矿浸出率的措施还有______和_______。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______,加入其目的是_________。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
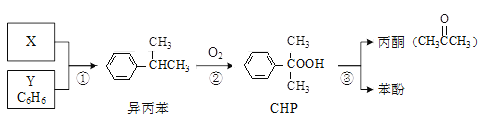
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
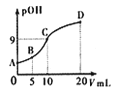
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中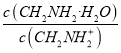 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com