
【题目】铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示:
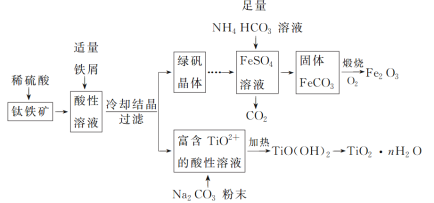
回答下列问题:
(1)FeTiO3中Fe的化合价为_______。
(2)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有_______ (任写两种)。酸性溶液中加入适量铁屑的目的是将_______。
(3)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35 ℃以下,其原因是_______,该反应的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。
(4)TiO2+转化为TiO(OH)2需要加热,加热的目的是_______,该反应的离子方程式为TiO2++2H2O![]() TiO(OH)2↓+2H+。
TiO(OH)2↓+2H+。
(5)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-)=3.0×10-6 mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2_______?
【答案】+2 采用钛铁矿粉末、升高温度、使用浓度较大的稀硫酸等(任写两种) Fe3+还原为Fe2+ 减少NH4HCO3分解、减少Fe2+水解 促进水解,加快反应速率 无
【解析】
钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有少量Fe2O3]加硫酸溶解生成TiO2+和Fe3+、Fe2+,加入铁还原铁离子:2Fe3++Fe=3Fe2+,得到硫酸亚铁和TiOSO4,对溶液蒸发浓缩、冷却结晶,过滤得到绿矾晶体和TiOSO4溶液,将TiOSO4溶液加热,促进TiO2+的水解生成TiO(OH)2,TiO2++2H2O=TiO(OH)2+2H+,分解得到TiO2nH2O;绿矾晶体溶于水,加入足量碳酸氢铵溶液可生成碳酸亚铁和二氧化碳,通入氧气煅烧可生成氧化铁,以此解答该题。
(1)由化合物中各元素的化合价代数和为0可知FeTiO3中Fe的化合价为+2;
(2)增大反应物接触面积、提高反应温度或提高反应物浓度均能加快反应速率。Fe具有还原性,可将Fe3+还原为Fe2+;
(3)温度太高,则NH4HCO3易分解,且降低温度可减少Fe2+的水解;
(4)TiO2+水解生成TiO(OH)2,加热可以加快水解反应速率;
(5) Ksp(FeCO3)=c(Fe2+)·c(CO32-),故c(Fe2+)=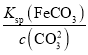 =1.0×10-5mol·L-1,pH=8.5,则c(OH-)=10-5.5mol·L-1,故c(Fe2+)·c2(OH-)=10-16<Ksp[Fe(OH)2]=8.0×10-16,故所得的FeCO3中无Fe(OH)2。
=1.0×10-5mol·L-1,pH=8.5,则c(OH-)=10-5.5mol·L-1,故c(Fe2+)·c2(OH-)=10-16<Ksp[Fe(OH)2]=8.0×10-16,故所得的FeCO3中无Fe(OH)2。


科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬独液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 AG 表示溶液酸度:AG=lg![]() 。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
。常温下,用 0.1 mol·L-1 的 NaOH 溶液滴定 25 mL 0.1 mol·L-1 的 CH3COOH。滴定结果可表示如图,下列分析正确的是( )
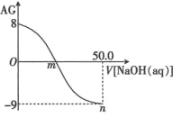
A.常温下 CH3COOH 的 Ka 数量级为 10-6
B.m 点加入 NaOH 的体积为 25 mL
C.n 点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在滴加 NaOH 溶液的过程中,溶液中 m 点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:
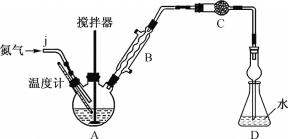
(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。
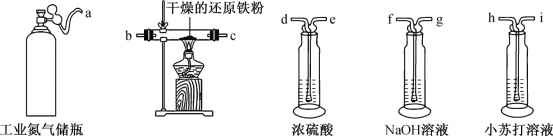
②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
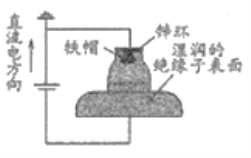
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,等物质的量的C2H4和CH4所含的氢原子数均为4NA
B.1L0.4mol/L亚硫酸钠溶液中H2SO3、HSO3-、SO32-的总数为0.4NA
C.向含4molFeI2的溶液中通入等物质的量的Cl2,转移的电子数为4NA
D.100g98%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
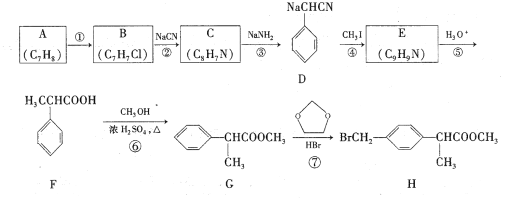
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是( )

A.在pH=1.3的溶液中:c(Na+)<c(H2R)+2c(R2-)
B.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小
C.在pH=2的溶液中存在![]() =10-3
=10-3
D.向Na2CO3溶液中加入过量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com