
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
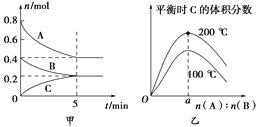
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
【答案】B
【解析】
试题分析:由图甲可知,反应中A、B、C的物质的量的变化量为0.4:0.2:0.2=2:1:1,根据反应中计量数之比等于物质的物质的量的变化量之比可知,该反应方程式为:2A(g)+B(g)![]() C(g),A、根据v=△c/t可知v(B)=
C(g),A、根据v=△c/t可知v(B)=![]() =0.02molL-1min-1,A错误;B、由图可知平衡时A、B、C的物质的量分别为0.4mol、0.2mol、0.2mol,所以它们的浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,结合化学方程式2A(g)+B(g)
=0.02molL-1min-1,A错误;B、由图可知平衡时A、B、C的物质的量分别为0.4mol、0.2mol、0.2mol,所以它们的浓度分别为:0.2mol/L、0.1mol/L、0.1mol/L,结合化学方程式2A(g)+B(g)![]() C(g),可知该反应的平衡常数为
C(g),可知该反应的平衡常数为![]() =25 L2/mol2,B正确;C、根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,所以升高温度平衡正向移动,同时反应速率增大,C错误;D、根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,△H>0;当投入的反应物的物质的量之比等于化学反应中计量数之比时,平衡时C的体积分数达最大值,根据化学方程式2A(g)+B(g)
=25 L2/mol2,B正确;C、根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,所以升高温度平衡正向移动,同时反应速率增大,C错误;D、根据图乙可知,升高温度,C的体积分数增大,平衡正向移动,所以正反应为吸热反应,△H>0;当投入的反应物的物质的量之比等于化学反应中计量数之比时,平衡时C的体积分数达最大值,根据化学方程式2A(g)+B(g)![]() C(g),可知a=2,D错误;答案选D。
C(g),可知a=2,D错误;答案选D。
【名师点晴】该题解题的关键是先要根据图像写出化学方程式,注意化学平衡图像题的解题技巧:(1)紧扣特征,弄清可逆反应的正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等。(2)先拐先平,在含量(转化率)—时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。(3)定一议二,当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】下列过程需要吸收热量的是
A. Na与H2O反应 B. 铝与磁性氧化铁在高温下反应
C. 形成氨气中的N-H键 D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活必需品,也是重要的化工原料。
(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯该粗盐的流程如下:
粗盐溶解![]()
![]() 滤液
滤液![]()
![]() 纯NaCl
纯NaCl
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液 c.NaOH溶液 d.BaCl2溶液 e.Ba(NO3)2溶液
欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,需依次加入三种试剂,顺序依次为
(填序号); ;
(2)食盐是工业上生产氯气和烧碱的重要原料。下图是工业上电解饱和食盐水的离子交换膜电解槽示 意图(阳极用金属钛网制成,阴极由碳钢网制成)。
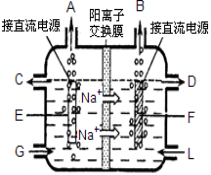
①F电极是 (填阴极或阳极);G处进口的物质是 ;
电解总反应的离子方程式为: 。
②通电几分钟后,如果将直流电源的正负极与电极接反,在电极F附近可以观察到的现象是 。
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液,制取消毒液的离子反应方程式为 ,当收集到22.4L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量最多为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Na、Mg、Al的有关性质的叙述正确的是
A. 碱性:NaOH<Mg(OH)2<Al(OH)3 B. 第一电离能:Na<Mg<Al
C. 电负性:Na>Mg>Al D. 还原性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
I.汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO发生分解反应时N2 的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>"或“ <”)。
2NO(g)的△H__________0(填“>"或“ <”)。

(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)_________。该温度下,若增大压强此反应的平衡常数将____________(填“增大”、“减小”、“不变”或“无法确记”);若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后O2的转化率为__________。
II.甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
(3)甲醇燃料电池(简称DMFC )由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如右图所示:
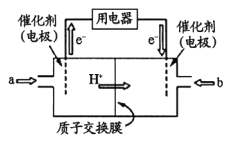
通入a气体的电极是原电池的____________极(填“正”或“负”),其电极反应式为_______________。
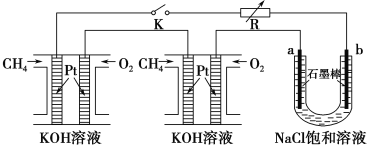
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量为0.224L (标况),且反应完全,则理论上通过电解池的电量为 __________(法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw关系的描述正确的是
A.K> Kw B.K= Kw C.K< Kw D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸溶液中c(H+)=0.1 mol·L-1,则该溶液的物质的量浓度
A. 一定等于0.1 mol·L-1 B. 一定大于0.1 mol·L-1
C. 一定小于0.1 mol·L-1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各基态原子的电子排布式正确的是( )
①Be:1s22s12p1 ②O:1s22s22p4
③He:1s12s1 ④Cl:1s22s22p63s23p5
A. ①② B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成1molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com