
【题目】一种储能较大的新型可充电锌溴液流电池工作原理如图所示。下列说法不正确的是( )
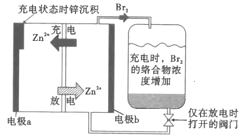
A.电极a在充电时连接电源的负极
B.放电时,电极b发生的反应是Zn2++2e-=Zn
C.放电时,电极b附近的Zn2+和Br-的浓度均增加
D.电池采用澳络合剂将溴单质络合,可以提高系统的安全性
【答案】B
【解析】
由电池工作原理图可知,电池放电时为原电池,阳离子向正极移动,由Zn2+向电极b移动可知,电极b为正极,电极a为负极,故充电时电极a为阴极,电极b为阳极,据此分析。
A.观察充电时Zn2+的移动方向,可以判断电极a是阴极,连接电源的负极,故A正确;
B.由充电时Br2络合物浓度增加,则放电时Br2络合物浓度减少,所以放电时电极b发生的反应是Br2+2e-=2Br-,故B错误;
C.放电时,由于生成Br-,且Zn2+移向电极b,因此电极b附近的Zn2+和Br-浓度均增加,故C正确;
D.由于Br2易挥发,有剧毒,将其采用络合剂络合后,可以提高安全性,故D正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
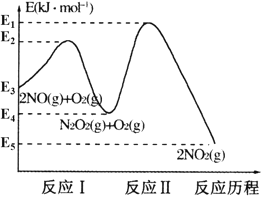
回答下列问题:
(1)写出反应I的热化学方程式___。
(2)反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物心舒宁(又名冠心宁)是一种有机酸盐,用于治疗心脉瘀阻所致的冠心病、心绞痛等,可用以下路线合成。
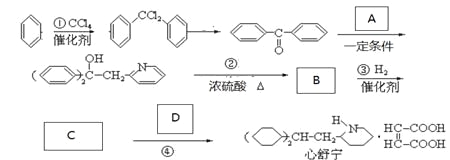
完成下列填空:
47、写出反应类型:反应①______________、反应②_______________。
48、写出结构简式:A__________________、C____________________。
49、由1mol B转化为C,消耗H2的物质的量为_______________。如果将③、④两步颠倒,则最后得到的是(写结构简式)__________________________。
50、D有同类别的同分异构体E,写出E与乙二醇发生缩聚反应所得产物的结构简式______________。
51、写出与A的属于芳香族化合物的同分异构体与盐酸反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是
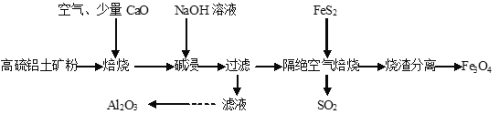
A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B.向滤液中通入过量HCl气体、过滤、洗涤、灼烧沉淀可制得Al2O3
C.隔绝空气焙烧时理论上反应消耗的n(FeS2):n(Fe2O3)=1:5
D.烧渣分离可用磁选法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2![]() 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是生活中常见的有机物,可以发生下列转化:
请根据题意填空:
(1)交警查酒驾,通常让司机向盛有酸性重铬酸钾的测试仪吹气,若变色,说明司机饮了酒,该过程中乙醇最终被氧化为___________________(填“CH3CHO”或“CH3COOH”);
(2)CH3CH2OH的官能团是____________(填“羟基”或“羧基”);
(3)CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和_____________(填“催化剂”或“氧化剂”)。
CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和_____________(填“催化剂”或“氧化剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池能够实现千余次充放电,但长时间使用后电池会失效,其中的化学试剂排放至环境中不仅会造成环境污染,还会造成资源的浪费。实验室模拟回收锂离子电池中的Co、Ni、Li的流程如图。
已知:LiCoO2难溶于水,易溶于酸。回答下列问题:
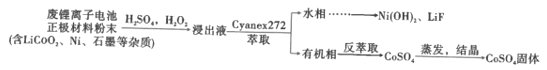
(1)LiCoO2中Co的化合价是__。
(2)LiCoO2在浸出过程中反应的离子方程式是__。
(3)浸出剂除了H2O2外,也可以选择Na2S2O3,比较二者的还原效率H2O2__(填“>”或“<”)Na2S2O3(还原效率:还原等物质的量的氧化剂消耗还原剂的物质的量)。
(4)提高浸出效率的方法有__。
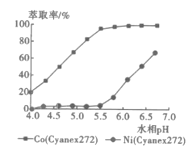
(5)利用Cyanex272萃取时,pH对钴、镍萃取分离效果的影响如图。从图中数据可知,用Cyanex272萃取分离时,最佳pH是__。
(6)反萃取的离子方程式为2H++CoR2=Co2++2HR,则反萃取剂的最佳选择是__。
(7)常温下,若水相中的Ni2+的质量浓度为1.18g·L-1,则pH=__时,Ni2+开始沉淀。[Ksp(Ni(OH)2=2×10-15]
(8)参照题中流程图的表达,结合信息设计完成从水相中分离Ni和Li的实验流程图(如图)___。
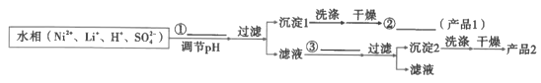
已知:
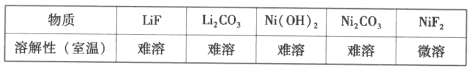
提供的无机试剂:NaOH、Na2CO3、NaF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家们研究开发了一种柔性手机电池,示意图如图所示[其中多硫化锂(Li2Sx)中x=2、4、6、8]。下列说法错误的是
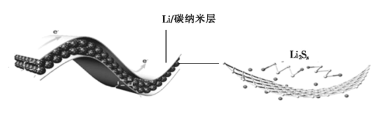
A.碳纳米层具有导电性,可用作电极材料
B.放电时,Li+移向Li2Sx膜
C.电池工作时,正极可能发生反应:2Li2S6+2Li++2e-=3Li2S4
D.电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制含碳、氮、硫的化合物等大气污染物对打造宜居环境具有重要意义。
(1)已知反应![]() 的
的![]() 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收![]() 的能量,则
的能量,则![]() 分子中化学键断裂时需要吸收的能量为______kJ。
分子中化学键断裂时需要吸收的能量为______kJ。
(2)用![]() 消除
消除![]() 污染的反应原理如下:
污染的反应原理如下:![]() ,不同温度条件下,
,不同温度条件下,![]() 与NO的物质的量之比分别为
与NO的物质的量之比分别为![]() 时,得到
时,得到![]() 脱除率曲线如图所示:
脱除率曲线如图所示:
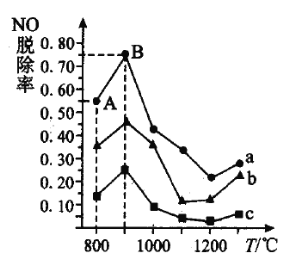
曲线![]() 对应
对应![]() 与
与![]() 的物质的量之比是_______。
的物质的量之比是_______。
②曲线![]() 中
中![]() 的起始浓度为
的起始浓度为![]() ,从
,从![]() 点到
点到![]() 点经过
点经过![]() ,该时间段内
,该时间段内![]() 的脱除速率为_________________
的脱除速率为_________________![]() 。
。
(3)已知常温下电离平衡常数:![]() 的
的![]() 的
的![]() 。
。
①溶液中下列微粒可以大量共存的是___________(填字母)。
a.![]() b.
b.![]() c.
c.![]()
②常温下,某种碳酸钠与碳酸氢钠混合溶液的![]() ,则
,则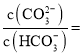 _____________。
_____________。
(4)利用电解法处理高温空气中稀薄的![]() (
(![]() 浓度约为
浓度约为![]() 的10倍),装置示意图如图所示,固体电解质可传导
的10倍),装置示意图如图所示,固体电解质可传导![]() 。
。
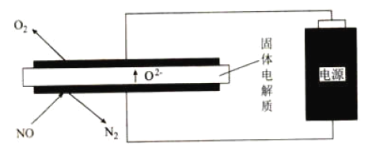
①阴极的电极反应式为_______________。
②消除一定量的![]() 所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com