
分析 X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,原子只能有2个电子层,最外层电子数为3,故X为B元素;Y是短周期元素中金属性最强的元素,则Y为Na;Z的最外层电子数与次外层电子数之比为3:4,则Z为S元素,W原子序数最大,故W为Cl,以此解答该题.
解答 解:(3)由以上分析可知Z为S,位于周期表3周期ⅥA,W为Cl最高价氧化物对应水化物的化学式为HClO4,故答案为:3周期ⅥA; HClO4;
(4)隔绝空气加热,Na单质可与X的氧化物B2O3反应制备B单质,该反应的化学方程式为:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O,
故答案为:6Na+B2O3$\frac{\underline{\;\;△\;\;}}{\;}$2B+3Na2O;
(5)S2Cl2与水反应生成一种能使品红溶液褪色的气体为二氧化硫,只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl,故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
点评 本题考查结构性质位置关系应用,为高考常见题型,推断元素是解题关键,侧重考查学生运用知识分析问题、解决问题的能力,难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
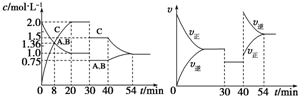
| A. | 30~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=1,正反应为吸热反应 | |
| C. | 30 min 时降低温度,40 min 时升高温度 | |
| D. | 30 min时减小压强,40 min时升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Cu>Fe2+ | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶作袋装食品的干燥剂没有发生化学变化 | |
| B. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| C. | Al2O3用作耐火材料,Al(OH)3用作阻燃剂 | |
| D. | 小苏打是治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
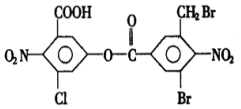
| A. | 5mol,10mol | B. | 6mol,2mol | C. | 8mol,4mol | D. | 8mol,2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com