
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
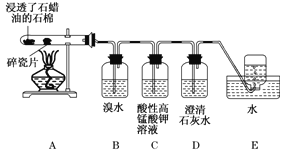
(1)A中碎瓷片的作用是____________。
(2)B装置中反应的化学方程式为___________。
(3) C装置中的实验现象______________ 。
(4) 查阅资料,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填装置字母)中的实验现象可判断该资料是否真实。
【答案】催化作用 CH2=CH2+Br2→CH2BrCH2Br 酸性高锰酸钾溶液褪色 D
【解析】
根据实验装置图,A为石蜡油在炽热碎瓷片作催化剂的作用下生成乙烯,乙烯通过溴水,与溴发生加成反应,使溴水褪色,乙烯通过高锰酸钾溶液,被高锰酸钾氧化成二氧化碳,使高锰酸钾褪色,生成的二氧化碳能使澄清石灰水变浑,最后用排水集气法收集反应剩余的气体,据此分析作答。
(1)石蜡油在炽热碎瓷片的作用下产生乙烯,可知碎瓷片的作用主要是催化剂,加快反应速率,故答案为:催化作用;
(2)乙烯能够与溴发生加成反应生成1,2-二溴乙烷,溴水褪色,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(3)乙烯可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故答案为:酸性高锰酸钾溶液褪色;
(4)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,能使澄清石灰水变浑,D中澄清石灰水如果变浑浊,说明生成二氧化碳,所以根据D中的实验现象可判断该资料是否真实,故答案为:D。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)

(1)仪器①的名称是______。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2 ![]() ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
(3)B装置反应前,先进行的实验操作是______。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是______。
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
(6)制备纳米级银粉:用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2︰1,且生成的含硫物质只有一种,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件相同时,反应N2+02=2NO分别在有、无催化剂时的能量变化如下图所示,下列说法中不正确的是( )

A. 该反应中反应物的总能量比生成物的总能量低
B. 加入催化剂能改变反应的焓变
C. 加入催化剂可以改变反应的活化能
D. 0.2 mol NO完全分解成N2和02时共放出热量18.26 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

![]()
A. 两步反应均为吸热反应 B. 三种化合物的稳定性顺序:B﹤A﹤C
C. 加入催化剂不改变反应的焓变,但能提高转化率 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )

A、d为负极,发生氧化反应
B、c为锌片,电池工作时,溶液中SO42-向c移动
C、电池工作的过程中,d电极上产生大量的气泡
D、电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
2NH3 △H<0达到平衡后,只改变一个条件,下列叙述错误的是
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 增大氮气的浓度,N2的平衡转化率减小,H2的平衡转化率增大
D. 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图银锌原电池中,以硫酸铜为电解质溶液。

(1)锌为______极,该电极上发生的是_____________反应(“氧化”或“还原”),电极反应式为__________________________________。
(2)银为____极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式是__________________,银片上观察到的现象是__________________________。
(3)该原电池的总反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
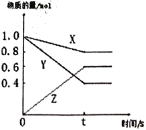
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com