
【题目】Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)

(1)仪器①的名称是______。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2 ![]() ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为______。
(3)B装置反应前,先进行的实验操作是______。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是______。
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
(6)制备纳米级银粉:用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2︰1,且生成的含硫物质只有一种,写出该反应的离子方程式______。
【答案】圆底烧瓶 ZnS2O4+2NaOH![]() Na2S2O4 + Zn(OH)2 打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2 加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出(用沉淀溶解平衡解释可以) 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 2Ag++S2O42—+4OH—=2Ag↓+2SO32—+2H2O
Na2S2O4 + Zn(OH)2 打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2 加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出(用沉淀溶解平衡解释可以) 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 2Ag++S2O42—+4OH—=2Ag↓+2SO32—+2H2O
【解析】
装置A中70%的浓硫酸通过分液漏斗滴到蒸馏烧瓶中和亚硫酸钠反应制得二氧化硫,二氧化硫和Zn在三颈烧瓶中反应生成ZnS2O4,加入NaOH溶液,ZnS2O4与NaOH反应Na2S2O4和Zn(OH)2沉淀,装置C中氢氧化钠溶液吸收二氧化硫尾气,防止污染空气。
(1)仪器①的名称是圆底烧瓶,故答案为:圆底烧瓶;
(2)28~35℃下,反应生成的ZnS2O4与NaOH溶液反应,反应生成Na2S2O4和Zn(OH)2沉淀,反应的化学方程式为ZnS2O4+2NaOH![]() Na2S2O4 + Zn(OH)2,故答案为:ZnS2O4+2NaOH
Na2S2O4 + Zn(OH)2,故答案为:ZnS2O4+2NaOH![]() Na2S2O4 + Zn(OH)2;
Na2S2O4 + Zn(OH)2;
(3)由于Na2S2O4具有极强的还原性,易被空气氧化,所以B装置反应前应排尽装置中的空气,防止氧气干扰实验,故答案为:打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2打开A中分液漏斗活塞,使硫酸与亚硫酸钠先反应产生的SO2,排出装置中残留的O2;
(4)加入氯化钠的目的是,溶液中Na+离子浓度增大,使Na2S2O4的溶解度降低,更易结晶析出,提高产率,故答案为:加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出;
(5)因固体中含有的Na2SO3、Na2S2O3会干扰Na2SO4的检验,应先加入足量稀盐酸,排除Na2SO3、Na2S2O3的干扰,再加入BaCl2溶液,检验是否存在Na2SO4,故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(6)由题意可知,AgNO3溶液和碱性Na2S2O4溶液反应生成纳米级的银粉,反应中Ag元素化合价升高,做氧化剂, Na2S2O4做还原剂被氧化,因氧化剂和还原剂的物质的量之比为2︰1,由得失电子数目守恒可知S2O32-被氧化为SO32-,反应的方程式为:2Ag++S2O42-+4OH-=2Ag+2SO32-
+2H2O,故答案为:2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈。下列说法正确的是( )

A. 液滴中的Cl﹣ 由a区向b区迁移
B. 铁腐蚀严重的区域,生锈也严重
C. 液滴下的Fe因发生还原反应而被腐蚀
D. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e﹣═4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是

A. NH4Cl的电离方程式为:NH4Cl![]() Cl-+NH4+
Cl-+NH4+
B. M点时,pH≈9
C. a=0.05
D. 当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.“碳纳米泡沫”被称为第五形态的单质碳,它与石墨互为同素异形体
B.分子组成相差一个或若干个CH2原子团的物质,彼此一定互为同系物
C.宇宙中新发现的H3分子与H2分子互为同位素
D.![]() 和
和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
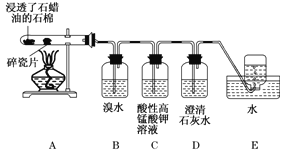
(1)A中碎瓷片的作用是____________。
(2)B装置中反应的化学方程式为___________。
(3) C装置中的实验现象______________ 。
(4) 查阅资料,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填装置字母)中的实验现象可判断该资料是否真实。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com