
【题目】下列说法正确的是( )
A. 离子化合物一定是由金属与非金属元素组成的
B. 共价化合物中可能含有离子键
C. 离子化合物中可能含有共价键
D. 只含有共价键的物质是共价化合物
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是

A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)③、④、⑤、⑥简单离子半径由小到大的顺序为_____________________。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

(a)X溶液与Y溶液反应的离子方程式为_________,
(b)N→⑥的单质的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,以下有关说法不正确的是
A. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
B. 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料
C. 造纸工艺中使用明矾,会导致纸张发生酸性腐蚀,使纸张变脆,易破损
D. 海水是巨大的资源宝库,可以利用化学方法从海水中提取Br2、Mg、NaCl等物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全备受社会关注。下列做法符合食品安全要求的是( )
A.在食用猪血中加甲醛溶液
B.在奶粉中添加三聚氰胺以提高蛋白质含量
C.在焙制面包时添加小苏打
D.在玉米馒头中添加合成色素柠檬黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别植物油和矿物油的正确方法是( )
A.加酸性高锰酸钾溶液,振荡
B.加NaOH溶液,煮沸
C.加新制Cu(OH)2悬浊液,煮沸
D.加溴水,振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
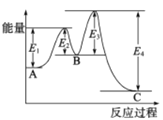
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为________________________________。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因__________________________________________。
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
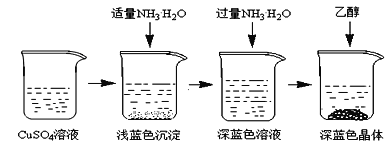
(3)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式___________________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是________________________。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
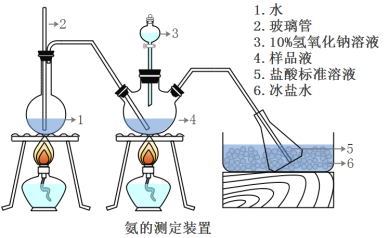
(5)A装置中长玻璃管的作用_________________,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏高的原因是____________________。
A.滴定时未用NaOH标准溶液润洗滴定管。
B.读数时,滴定前平视,滴定后俯视。
C.滴定过程中选用酚酞作指示剂。
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com