
【题目】下列物质中,有固定沸点的是 ( )
A. 石油 B. 聚氯乙烯 C. 石油液化气 D. 苯
科目:高中化学 来源: 题型:
【题目】苯氧乙醇是护肤产品中常用的一种有机物,下图是利用烃M和苯酚为主要原料制备苯氧乙醇的合成路线,请回答相关问题。
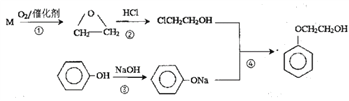
(1)反应①中M与氧气的物质的量之比为2:1且原子利用率为100%,则M的结构简式是_______________,反应①的反应类型是___________________。
(2)ClCH2CH2OH的名称是_____________________。
(3)苯氧乙醇中含有的官能团是___________________,分子式是___________________。
(4)苯酚除了与氢氧化钠反应外也可以与碳酸钠反应生成苯酚钠,该反应的化学方程式是_____________
(5)苯氧乙醇的同分异构体中符合下列要求的有__________种(不考虑一个碳原子上连两个羟基的情况)。
a.属于芳香化合物且苯环上有奇数个取代基
b.能与钠反应生成氢气且只含有一种官能团
其中核磁共振氢谱中峰的数目最少的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知: ![]()
![]()
则CO还原Fe2O3(s)的热化学方程式为________________________________。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下:NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)______c(HCO3-)(填“>”“<”或“=”),计算反应NH4+ + HCO3- + H2O NH3·H2O + H2CO3的平衡常数K=______________,物料守恒表达式为__________________________。
(3)以CO2为原料还可以合成多种物质。
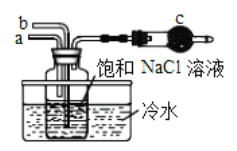
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_______处向饱和NaCl溶液中通入_________气体(填NH3或CO2),然后再在通入另一种气体。请写出反应的化学方程式_______________________。
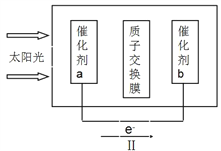
②人工光合作用能够借助太阳能用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,5.6 L A气体的质量是15 g ,则A的相对原子质量为___。
(2)一定量的液态化合物XY2,与一定量O2在一密闭容器中恰好完全反应:XY2(液)+3O2(气)=XO2(气)+2YO2(气),冷却至标准状况,测得容器内气体的体积为6.72L,密度为2.5g/L。则:化合物XY2的摩尔质量为________。
(3)质量之比为16:7:6的三种气体SO2、CO、NO,分子数之比为___________,氧原子数之比为__________,相同条件下的体积之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据CH2=CH﹣CH2COOH的结构,它不可能发生的反应是( )
A.与银氨溶液反应析出银
B.使溴的四氯化碳溶液褪色
C.与乙醇在浓硫酸催化下发生酯化反应
D.与新制氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计下图实验装置(夹带装置略去)制备Cl2,并探究氯气的相关性质。
已知: 硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂。
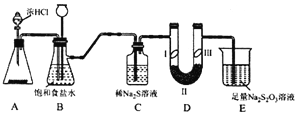
(1)若A装置中固体药品为KMnO4,产生标况下3.36L氯气时,被氧化的HCl的物质的量为___。
(2)装置B的作用是_____________。
(3)装置C的作用是探究氯气与Na2S溶液反应。反应开始后,观察到C中产生黄色沉淀。写出该反应的化学方程式_____________。
(4)装置D的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________、____________。
【探究与反思】
按图中设计装置进行实验,甲同学观察到C中先产生黄色沉淀。但是长时间通入氯气后,溶液又变澄清,该同学思考后设计如下实验检验C中生成物的成分。
实验操作步骤:
①取少量原Na2S溶液于小试管中,滴加BaCl2溶液,无明显现象;
②取少量反应后C中澄清溶液于小试管中,滴加过量的盐酸,无气泡冒出,再滴加BaCl2溶液,产生白色沉淀。
(5)该同学根据实验现象得出结论:装置C 中生成的含硫元素的物质是______ (填化学式)。推测过量的氯气与Na2S溶液反应的离子方程式为________________。
(6)请用离子方程式说明装置E的作用______________。
(7)乙同学认真思考后认为装置E中的试剂不合理。请用离子方程式和必要的文字解释原因:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将( )
A.和氯气单独通过时相同B.和二氧化硫单独通过时相同
C.是二者作用效果之和D.可能失去漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com