
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知: ![]()
![]()
则CO还原Fe2O3(s)的热化学方程式为________________________________。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下:NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)______c(HCO3-)(填“>”“<”或“=”),计算反应NH4+ + HCO3- + H2O NH3·H2O + H2CO3的平衡常数K=______________,物料守恒表达式为__________________________。
(3)以CO2为原料还可以合成多种物质。
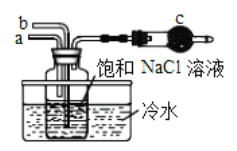
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_______处向饱和NaCl溶液中通入_________气体(填NH3或CO2),然后再在通入另一种气体。请写出反应的化学方程式_______________________。
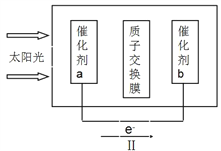
②人工光合作用能够借助太阳能用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:____________________。
【答案】 ![]()
![]() > 1.25×10-3 c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3) a NH3 NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl
> 1.25×10-3 c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3) a NH3 NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl ![]()
【解析】(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=akJmol-1,②C(石墨)+CO2(g)=2CO(g)△H2=bkJmol-1,依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b) kJmol-1,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b) kJmol-1;
(2)根据NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11可知,铵根离子的水解程度小于碳酸氢根离子,因此c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=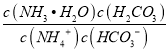 =
=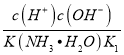 =
=![]() =1.25×10-3;NH4HCO3溶液中的物料守恒表达式为c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),故答案为:>;1.25×10-3;c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)。
=1.25×10-3;NH4HCO3溶液中的物料守恒表达式为c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),故答案为:>;1.25×10-3;c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)。
(3)①二氧化碳在水中的溶解度较小,氨气极易溶于水,因此实验时先向饱和氯化钠溶液中通入氨气,再通入二氧化碳,为了防止倒吸,应从a口通入氨气,b口通入二氧化碳,反应的方程式为NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl,故答案为:a;NH3;NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl;
②根据装置图中电子的流向,判断催化剂a为阳极电极反应:2H2O-4e-═O2+4H+,酸性增强;催化剂b为阴极,电极反应:CO2+2H++2e-═HCOOH,酸性减弱,总的电池反应为2H2O+2CO2═2HCOOH+O2,故答案为:CO2+2H++2e-═HCOOH;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况}。向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
A. 该合金中铜与铁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. 得到2.54g沉淀时,加入NaOH溶液的体积是600mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是:
A.14C中含有14个中子
B.C60、C70、金刚石、石墨均为碳的同素异形体
C.1H2O与2H2O互称同位素
D.1H、2H、3H是同一种核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com