
【题目】肉桂酸甲酯的球棍模型如图所示(图中球与球之间连线表示 单键或双键)。
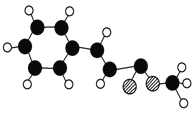
(1)肉桂酸甲酯的分子式为 。
(2)肉桂酸甲酯能发生的反应类型是 (填字母代号)。
A.加成反应 B.酯化反应 C.消去反应 d 取代反应
(3)肉桂酸甲酯与NaOH溶液反应生成的相对分子质量较小的有机物的结 构简式是 。
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2S 可用于制防污涂料,其可由热的铜在硫蒸气或H2S 中反应制得。
(1)铜元素在元素周期表中的位置为 ____________,Cu+的核外电子排布式为_________,基态铜原子核外电子共有__________种运动状态。
(2)Cu2S在一定条件下可被氧化为CuSO4。
①在SO42—中S原子的杂化轨道类型为________;SiO44—、PO43—与 SO42—互为________;其中Si、P、S第一电离能由大到小顺序为________________ ;
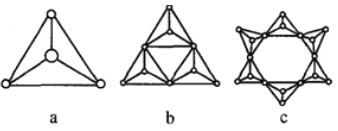
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图a 表示,图中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式_______________。
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如下:
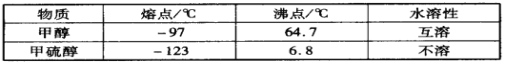
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是__________________________。
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如下图所示(1 pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=_________g/cm3(保留三位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为 。Y、W的氢化物沸点高的是 (写化学式),原因是 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原因 。
(4) Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素。请回答:
(1)基态Si原子的价层电子排布图为 ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为 。
(2)ClO3-、ClO4-中Cl都是以 轨道与O原子 轨道成键,其微粒的立体结构分别为 、 。
(3)N和Si形成的原子晶体中,N原子的配位数为 。
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色。大多数金属元素有焰色反应的微观原因为 ;N3-中σ键和π键的数目之比为 。B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为 (用元素符号表示)
(5)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成。则:
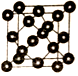
①晶胞中最小的环含有_____个原子。
②若晶体密度为ρg·cm3,阿伏伽德罗常数为NA,晶胞中两个最近的Si原子核之间的距离为____pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如图所示。其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
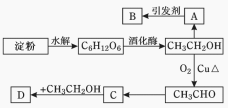
(1)C6H12O6的名称是________,A的电子式为_________,C中含有官能团名称 ;
(2)A→B反应类型____________;C→D反应类型____________。
(3)写出下列转化的化学方程式:
① A→B:______________________________________________________;
② A→CH3CH2OH:______________________________________;
③ C→D:_____________________________________________________;
④ CH3CH2OH→CH3CHO:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图填空。
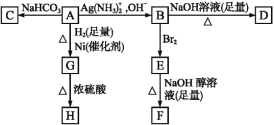
已知H是环状化合物C4H6O2,F的碳原子都在一条直线上。
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时发生两种反应,其反应类型分别是 。
(3)D的结构简式是 。
(4)1 mol A与2 mol H2反应生成1 mol G,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
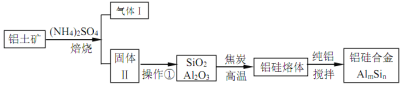
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
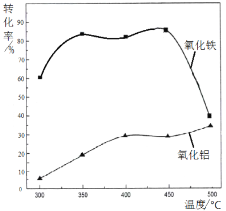
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e—="=" Cd + 2OH-
C. 放电时电池内部OH - 向正极移动
D. 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com