
【题目】某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断不正确的是( )
A.一定含有Fe 2+、Fe 3+、Cu2+、ClˉB.c(Clˉ) = 6mol / L,c(Fe 2+) = 0.6mol /L
C.c(Fe2+)︰c(Fe3+) = 3︰1D.c(Fe2+)︰c(Cu2+) = 2︰1
【答案】BC
【解析】
(1)取10mL废液加入足量的AgNO3溶液,生成沉淀8.61g,沉淀为AgCl,n(Cl-)=![]() =0.06mol,c(Cl-)=6mol/L,阴离子只此一种,带负电荷量也是0.06mol,则没加含铜绝缘板时应含有0.02mol Fe3+ (电荷守恒);加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol;
=0.06mol,c(Cl-)=6mol/L,阴离子只此一种,带负电荷量也是0.06mol,则没加含铜绝缘板时应含有0.02mol Fe3+ (电荷守恒);加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol;
(2)铜片质量减少了0.256g,即![]() =0.004mol,根据方程式Cu+2Fe3+═Cu2++2Fe2+可知废液中n(Fe3+)=0.008mol,c(Fe3+)=
=0.004mol,根据方程式Cu+2Fe3+═Cu2++2Fe2+可知废液中n(Fe3+)=0.008mol,c(Fe3+)=![]() ;
;
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),即3×0.8mol/L+2c(Fe2+)+2c(Cu2+)=6mol/L,且c(Fe2+)=2c(Cu2+),解得c(Fe2+)=1.2mol/L,c(Cu2+)=0.6mol/L。
A.废液放入铜片充分反应,铜片质量减少了0.256g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Cl-,故A正确;
B.根据分析可知c(Clˉ) = 6mol / L,c(Fe 2+) = 1.2mol /L,故B错误;
C.c(Fe2+)︰c(Fe3+) = 1.2mol /L:0.8mol/L=3:2,故C错误;
D.由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),故D正确;
故答案为BC。


科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
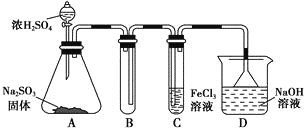
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和溶液中:①溶液的质量;②溶剂的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度,从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
A.④⑤⑥B.①②③④C.①②④⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
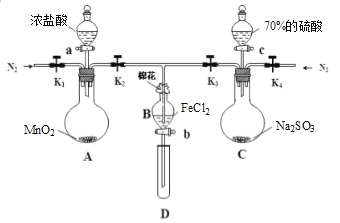
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多含氯化合物都是重要的漂白剂
Ⅰ、亚氯酸钠(NaClO2)是一种常见漂白剂,某探究小组开展如下实验,回答下列问题:
制取NaClO2晶体按如下图装置进行制取。
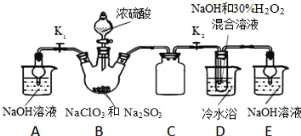
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是______;检验该离子的方法是____________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________。
Ⅱ、ClO2也是一种常见漂白剂,用ClO2处理过的饮用水常含有一定量有害的ClO![]() 。我国规定饮用水中ClO
。我国规定饮用水中ClO![]() 的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO
的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO![]() 的含量的过程如下:
的含量的过程如下:
①量取25.00 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-===2ClO![]() +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45 mL。此过程发生反应:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-。
+2I-。
④调节第③步所得溶液至pH≤2.0,此过程发生反应ClO![]() +4H++4I-===Cl-+2I2+2H2O。
+4H++4I-===Cl-+2I2+2H2O。
⑤再向溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液30.00 mL
根据上述数据计算并判断该水样中ClO![]() 的含量是否符合国家规定。
的含量是否符合国家规定。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 溶液焰色反应时,如果火焰呈黄色就说明该溶液一定有钠元素,一定没有钾元素
B. 除去CO2中的HCl气体,只需将气体通过NaOH溶液
C. 在某溶液中滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO![]()
D. 在氧化还原反应中,阳离子也能失去电子被氧化,阴离子也能得到电子被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com