
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察图,标准液盐酸应放入__滴定管中。(填“甲”或“乙”)

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__,滴定终点的现象为__。
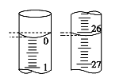
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为__mL,所用盐酸溶液的体积为___mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据表中数据计算该NaOH溶液的物质的量浓度__。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
【答案】甲 溶液中颜色变化 当滴入最后一滴HCl溶液,颜色由黄色变为红色,且30s内不恢复 0.00 26.10 0.1044mol/L D
【解析】
酸碱中和滴定的计算中,一般取三次滴定的数据的平均值计算,但此题中,第二次数据明显异常,要舍去;滴定中的误差分析,要根据公式![]() 来分析,其中
来分析,其中![]() 和
和![]() 是定值,
是定值,![]() 与
与![]() 成正比。
成正比。
(1)标准液盐酸应放入酸式滴定管中,甲为酸式滴定管,故答案为:甲;
(2)滴定时,眼睛注视锥形瓶中颜色变化,滴定终点的现象为:当滴入最后一滴HCl溶液,颜色由黄色变为红色,且30s内不恢复,故答案为:液面颜色;当滴入最后一滴HCl溶液,颜色由黄色变为红色,且30s内不恢复;
(3)酸式滴定管读数时,视线要与凹液面的最低处保持水平,所取液体为二次读数之差,第一次读数为:0.00 mL,第二次读数为:26.10 mL,故答案为:0.00;26.10;
(4)根据公式,![]() ,
,![]() ,故答案为:0.1044mol/L;
,故答案为:0.1044mol/L;
(5)根据公式![]()
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,使标准酸的浓度变小,![]() 增大,NaOH溶液的浓度偏大,A不符合;
增大,NaOH溶液的浓度偏大,A不符合;
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,对待测液的物质的量无影响,故![]() 不变,NaOH溶液的浓度无影响,B不符合;
不变,NaOH溶液的浓度无影响,B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,![]() 增大,NaOH溶液的浓度偏大,C不符合;
增大,NaOH溶液的浓度偏大,C不符合;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,![]() 减小,NaOH溶液的浓度偏小,D符合,答案为:D。
减小,NaOH溶液的浓度偏小,D符合,答案为:D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】经测定乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.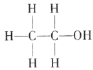 Ⅱ.
Ⅱ.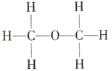
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。
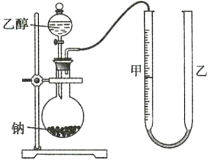
(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___(填“Ⅰ”或“Ⅱ”),原因是___。
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(3)学生丙不想通过称取乙醇的质量来确定乙醇的物质的量,那么他还需要知道的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由软锰矿浆(主要成分是MnO2)吸收含硫废渣产生的废气制备,工艺如下图所示。
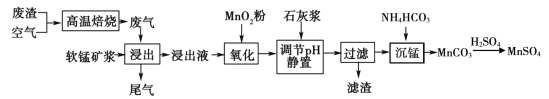
已知:浸出液的pH <2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。请回答下列问题:
(l)高温焙烧前需将矿石研成粉末,其目的是____。
(2)“氧化”中添加适量的MnO2的作用是____(用离子方程式表示);写出“沉锰”的离子方程式____。
(3)下列各组试剂中,能准确测定尾气中SO2含量的是____。(填编号)
a NaOH溶液、酚酞试液
b 稀H2SO4酸化的KMnO4溶液
c 碘水、淀粉溶液
d 氨水、酚酞试液
(4)滤渣的主要成分有____。
(5)若要从MnSO4溶液中得到高纯硫酸锰必须进行的实验操作顺序是____(用字母填空)。
a 过滤洗涤 b 蒸发浓缩 c 冷却结晶 d 干燥
(6)已知:![]() pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一端呈螺旋状的铜丝放在酒精灯上加热,铜丝表面生成黑色的___,再迅速把铜丝插入成盛有乙醇的试管中,看到铜丝表面___,反复多次,试管中有带___气味的___生成;所涉及反应的化学方程式为___,反应中乙醇被___(填“氧化”或“还原”),铜丝的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了___________原理或规则。
(2)基态Cu原子核外电子排布式为_______,则高温下的稳定性CuO _____ Cu2O(填“>”或“<”)。
(3)在尿素CO(NH2)2中C、N的杂化方式分别为________,OF2的空间构型是___________。
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是_____(用离子方程式表示)。
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_____,并写出一种与氨硼烷互为等电子体的分子______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuO有氧化性,能被NH3还原,为验证此结论,设计如下实验。
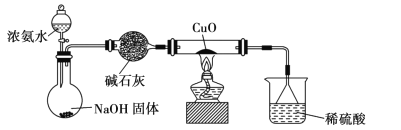
有关该实验的说法正确的是
A.反应时生成一种无污染的气体NO
B.NH3与CuO反应后生成的红色物质可能是Cu
C.装浓氨水的装置名称是分液漏斗,只能用作分液操作
D.烧杯中硫酸的作用是防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,如图为CO2的水溶液中加入强酸或强碱溶液后,平衡时溶液中各种组分的pC - pH图。依据图中信息,下列说法不正确的是
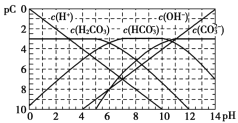
A.![]() 不能在同一溶液中大量共存
不能在同一溶液中大量共存
B.H2CO3电离平衡常数![]()
C.人体血液里主要通过碳酸氢盐缓冲体系(![]() )可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的
)可以抵消少量酸或碱,维持pH =7.4,但当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将变大
最终将变大
D.pH =9时,溶液中存在关系![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
过渡元素有特殊性能常用于合金冶炼,p区元素用于农药医药、颜料和光电池等工业。
(l)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫作_______
(2)基态亚铜离子中电子占据的原子轨道数目为____。
(3)Cr3+可以与CN -形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN -形成配位键,则Cr3+的配位数为 ______,1 mol该配离子中含有_______ molσ键。
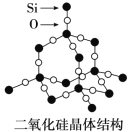
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如图所示,在二氧化硅晶体中,Si、O原子所连接的最小环为____元环,则每个O原子连接________个最小环。
(5)与砷同周期的p区元素中第一电离能大于砷的元素有 ________(填元素符号);请根据物质结构的知识比较酸性强弱亚砷酸(H3AsO3,三元酸)____HNO3(填>,=,<)。
(6) Zn与S形成晶胞结构如图所示,晶体密度为p g/cm3,则晶胞中距离最近的Zn、S之间的核间距离是____pm。(NA表示阿伏加德罗常数,用含p、NA等的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种物质之间的能量关系如图所示, 下列说法中正确的是
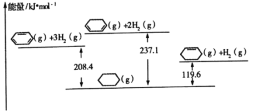
A.使用合适催化剂,能减小反应的焓变
B.![]() +H2(g)
+H2(g)![]()
![]() (g) ΔH=+28.7kJ/mol
(g) ΔH=+28.7kJ/mol
C.![]() (g)中,热能转化为产物内部的能量
(g)中,热能转化为产物内部的能量
D.![]() (g),反应物的总能量低于生成物的总能量
(g),反应物的总能量低于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com