
【题目】光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为___,第8 min时改变的条件是____。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___(填“增大”“不变”或“减小”),原因是_____。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)![]() COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2![]() 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl + CO![]() COCl 快速平衡
COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____(填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
1 | 0.100 | 0.100 | 1.2×10-2 |
2 | 0.050 | 0.100 | 4.26×10-3 |
3 | 0.100 | 0.200 | 2.4×10-2 |
4 | 0.050 | 0.050 | 2.13×10-3 |
CO的反应级数m =___,当实验4进行到某时刻,测得c(Cl2) = 0.010mol·L-1,则此时的反应速率v =___mol·L-1·s-1(已知:![]() ≈ 0.32)。
≈ 0.32)。
【答案】COCl2+4OH-==CO32-+2Cl-+2H2O CH4(g)+CO2(g)==2CO(g)+2H2(g) H= +247.3kJ·mol -1 5.56 移去部分CO 减小 正反应放热,升高温度,平衡逆向移动 AC 1 3.8×10-5
【解析】
(1)光气(COCl2)化学性质不稳定,遇水迅速产生两种酸性气体,气体为二氧化碳和氯化氢,据此书写反应的离子方程式;
(2)根据盖斯定律分析解答;
(3)①根据图象,平衡时COCl2的浓度为0.03mol/L,根据三段式计算平衡常数K;第8 min时,COCl2的浓度逐渐减小,CO的浓度突然减小,据此分析改变的条件;②该反应为放热反应,根据温度对平衡的影响分析解答;
(4)①反应的快慢由最慢的反应决定,结合反应历程分析判断;②根据表格数据,当c(Cl2)不变时,c(CO)增大1倍,反应速率增大1倍,说明v与c(CO)的一次方成正比,结合表格数据计算判断m和 k的值,当c(Cl2) = 0.010 mol·L-1,代入速率方程计算v。
(1)光气(COCl2)化学性质不稳定,遇水迅速产生两种酸性气体,气体为二氧化碳和氯化氢,因此少量COCl2与烧碱溶液发生反应的离子方程式为COCl2+4OH-==CO32-+2Cl-+2H2O,故答案为:COCl2+4OH-==CO32-+2Cl-+2H2O;
(2)①CH4(g)+2O2 =CO2(g)+2H2O(l)△H=-890.3 kJmol-1,②2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1,③2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJmol-1,根据盖斯定律,将①-②-③得:CH4(g)+CO2(g)==2CO(g)+2H2(g) H=(-890.3 kJmol-1)-(-571.6 kJ·mol-1)-(-566.0 kJmol-1)= +247.3kJ·mol -1,故答案为:CH4(g)+CO2(g)==2CO(g)+2H2(g) H= +247.3kJ·mol -1;
(3)①根据图象,平衡时COCl2的浓度为0.03mol/L,则
Cl2(g)+CO(g)![]() COCl2(g)
COCl2(g)
起始(mol/L)0.09 0.12 0
反应(mol/L)0.03 0.03 0.03
平衡(mol/L)0.06 0.09 0.03
反应在第6 min时达到平衡,平衡常数K=![]() =5.56;第8 min时,COCl2的浓度逐渐减小,CO的浓度突然减小,因此改变的条件是移去部分CO,故答案为:5.56;移去部分CO;
=5.56;第8 min时,COCl2的浓度逐渐减小,CO的浓度突然减小,因此改变的条件是移去部分CO,故答案为:5.56;移去部分CO;
②Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1,为放热反应;在第12 min时升高温度,平衡逆向移动,重新达到平衡时,COCl2的体积分数将减小,故答案为:减小;正反应放热,升高温度,平衡逆向移动;
COCl2(g) H=-108 kJ·mol-1,为放热反应;在第12 min时升高温度,平衡逆向移动,重新达到平衡时,COCl2的体积分数将减小,故答案为:减小;正反应放热,升高温度,平衡逆向移动;
(4)①A.根据反应历程,COCl属于反应的中间产物,故A正确;B.第一步和第二步反应能够快速达到平衡,说明反应容易进行,反应的活化能较低,故B错误;C.反应的快慢由最慢的反应决定,因此决定总反应快慢的是第三步,故C正确;D.第三步的反应较慢,说明有效碰撞频率较小,故D错误,故答案为:AC;
②速率方程v = k[c(Cl2)]3/2 [c(CO)]m,根据表格数据,当c(Cl2)不变时,c(CO)增大1倍,反应速率增大1倍,说明v与c(CO)的一次方成正比,m=1,则1.2×10-2= k(0.100)3/2 (0.100)1,因此当k=![]() ,因此当c(Cl2) = 0.010 mol·L-1,v =
,因此当c(Cl2) = 0.010 mol·L-1,v =![]() ×(0.0100)3/2 (0.0100)1mol·L-1·s-1 =3.8×10-5 mol·L-1·s-1,故答案为:1;3.8×10-5。
×(0.0100)3/2 (0.0100)1mol·L-1·s-1 =3.8×10-5 mol·L-1·s-1,故答案为:1;3.8×10-5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料的碳一化学处于未来化学产业的核心,成为科学家研究的重要课题。
(1))已知CO、H2、CH3OH(g)的燃烧热分别为-283.0 kJ·mol-1、-285.8 kJ·mol-1、-764.5 kJ·mol-1。则反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH=_____;。
CH3OH(g) ΔH=_____;。
(2)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。

①当起始n(H2)/n(CO)=2时,经过5 min达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将____(填“增大”“减小”或“不变”)。
②当n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为________。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_____L。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的负极为__(填“A”或“B”),写出阳极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,1 mol A 和 n mol B 在一个容积可变的容器中发生如下可逆反应:A(g) + 2B(g)2C(g),一段时间后达到平衡,生成 a mol C,则下列说法中正确的是 ( )
A. 物质 A、B 的转化率之比为 1∶2
B. 起始时刻和达到平衡后容器中混合气体的密度相等
C. 当υ正(A) = 2υ逆(C)时,可断定反应达到平衡状态
D. 若起始时放入 2 mol A 和 2n mol B,则达平衡时 C 的物质的量为 2a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co(CH3COO)2(乙酸钴)可用作酯交换反应的催化剂并可用于制备高质量锂电池电极。在氮气氛围中,乙酸钴受热分解生成CO、CO2和C2H6等产物。某研究小组利用下列装置检验乙酸钴热分解的部分产物。

已知:①CO+PdCl2+H2O==CO2+Pd↓(黑色)+2HCl;
②变色硅胶为深蓝色,吸水后变为粉红色。
回答下列问题:
(1)B装置的作用是____,要检验乙酸钴分解产物中的CO2,对以上装置的改进方案是______。
(2)仪器a中的试剂是_______,其作用是_______。
(3)能证明乙酸钴的分解产物含有C2H6的实验现象是______。
(4)装置D中C2H6被CuO完全氧化的化学方程式是________。
(5)另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·nH2O]在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:_____。
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
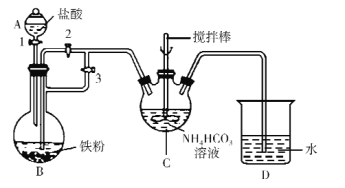
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。

则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的重要反应之一。
2SO3(g)是工业制硫酸的重要反应之一。
(1)①从平衡角度分析采用过量O2的原因是____________________。
②一定条件下,将0.10 mol SO2(g)和0.06 mol O2(g)放入容积为2 L的密闭容器中,反应在5min时达到平衡,测得c(SO3)=0.040 mol/L。
用SO2浓度变化来表示的化学反应速率为_________。
计算该条件下反应的平衡常数K=____________________________________。
③已知:该催化氧化反应K(300℃)>K(350℃)。则该反应正向是____________________反应(填“放热”或“吸热”)。平衡后升高温度,SO2的转化率_________(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同)。
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为![]() 甲_________
甲_________![]() 乙。
乙。
(4)下图表示在密闭容器中二氧化硫的催化氧化反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a~b过程中改变的条件可能是_________;b~c过程中改变的条件可能是_________;若增大压强时,反应速率和化学平衡变化情况画在c~d处。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
(1)CO可用于高炉炼铁。
已知:Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H=akJ·mol-1
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H=bkJ·mol-1
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H=____________kJ·mol-1(用含a、b的代数式表示)
(2)一定条件下,CO2和CO可以互相转化。某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | ωmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= ____________,该温度下反应的平衡常数K=____________。欲使平衡后乙容器与甲容器中相同气体的体积分数分别相等,则ω、x、y、z需满足的关系是y=____________,(用含x、w的代数式表示),且___________。
(3)已知反应C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:

则该反应的△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
(4)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为 ___。
(2)化合物(CH3)3N分子中N原子杂化方式为 ___,该物质能溶于水的原因是 ___。
(3)PH3分子的键角小于NH3分子的原因是 ___;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为____pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com