
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
(1)CO可用于高炉炼铁。
已知:Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H=akJ·mol-1
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H=bkJ·mol-1
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H=____________kJ·mol-1(用含a、b的代数式表示)
(2)一定条件下,CO2和CO可以互相转化。某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | ωmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= ____________,该温度下反应的平衡常数K=____________。欲使平衡后乙容器与甲容器中相同气体的体积分数分别相等,则ω、x、y、z需满足的关系是y=____________,(用含x、w的代数式表示),且___________。
(3)已知反应C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:

则该反应的△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
(4)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
【答案】![]() 0.2 molL-1min-1 1.8 x-2w y=z > p1>p2>p3
0.2 molL-1min-1 1.8 x-2w y=z > p1>p2>p3 ![]()
【解析】
(1)由盖斯定律计算可得;
(2)由题意建立三段式计算反应速率和化学平衡常数;等效平衡符合变化量之比等于化学计量数之比;
(3)升高温度,平衡向吸热方向移动,增大压强,平衡向气体体积减小的方向移动;
(1) 将已知反应依次编号为①、②,由盖斯定律①×![]() +②×
+②×![]() 得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),则△H=
得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),则△H=![]() kJ·mol-1,故答案为:
kJ·mol-1,故答案为:![]() ;
;
(2)由CO2的转化率为75%可知,二氧化碳的变化量为4 mol/L×75%=3 mol/L,由题给数据可以建立如下三段式:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起(mol/L) 4 8 0 0
变(mol/L) 3 3 3 3
平(mol/L) 1 5 3 3
0~15min内平均反应速率v(H2)=![]() =
=![]() =0.2 molL-1min-1;反应的平衡常数K=
=0.2 molL-1min-1;反应的平衡常数K=![]() =
=![]() =1.8;平衡后乙容器与甲容器中相同气体的体积分数分别相等,则甲乙为等效平衡,需满足(w-y):(x-y)=8:16,由变化量之比等于化学计量数之比可得:(8—ω):(16—x):y:z=1:1:1:1,解关系式可知y=z,y= x—2w,故答案为:0.2 molL-1min-1;1.8;x—2w;y=z;
=1.8;平衡后乙容器与甲容器中相同气体的体积分数分别相等,则甲乙为等效平衡,需满足(w-y):(x-y)=8:16,由变化量之比等于化学计量数之比可得:(8—ω):(16—x):y:z=1:1:1:1,解关系式可知y=z,y= x—2w,故答案为:0.2 molL-1min-1;1.8;x—2w;y=z;
(3)由图可知,温度越高、乙苯的平衡转化率越大,说明平衡向正反应方向移动,则△H>0;该反应是一个气体体积减小的反应,增大压强,平衡向逆反应方向移动,则p1>p2>p3,故答案为:>;p1>p2>p3;
(4)反应达平衡时必然有v正=v逆,即k正·c(CO)·c(NO2)=k逆·c(CO2)·c(NO),则![]()
![]() =k,故答案为:
=k,故答案为:![]() 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为___,第8 min时改变的条件是____。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___(填“增大”“不变”或“减小”),原因是_____。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)![]() COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2![]() 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl + CO![]() COCl 快速平衡
COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____(填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
1 | 0.100 | 0.100 | 1.2×10-2 |
2 | 0.050 | 0.100 | 4.26×10-3 |
3 | 0.100 | 0.200 | 2.4×10-2 |
4 | 0.050 | 0.050 | 2.13×10-3 |
CO的反应级数m =___,当实验4进行到某时刻,测得c(Cl2) = 0.010mol·L-1,则此时的反应速率v =___mol·L-1·s-1(已知:![]() ≈ 0.32)。
≈ 0.32)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:反应②N2(g)+O2(g)![]() 2NO(g) △H2=+180.5kJ·mol-1
2NO(g) △H2=+180.5kJ·mol-1
CO的燃烧热为283.0kJ·mol-l,则△H1=___。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。

①温度:T1____T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如上图2所示。若低于200℃,图2中曲线中脱氮率随温度升高而变化不大的主要原因为____;a点 ___(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述正确的是____。
A.N2O分解反应中:k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E各物质的关系如下图所示:

已知:X能使湿润的红色石蕊试纸变蓝。
(1)无色液体A是_____,A与B反应的化学方程式是____________。
(2)由X转化为N2的化学方程式为______________。
(3)白色固体C的化学式为 _____。由D转化为E的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
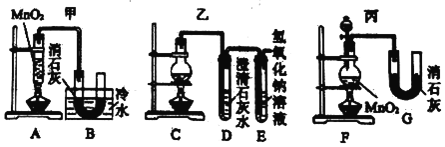
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
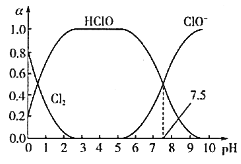
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及其化合物有许多用途。回答下列问题:
(1)基态铁原子核外共有____________种不同空间运动状态的电子,铁、钴、镍基态原子核外未成对电子数最少的价层电子的电子排布图(轨道表达式)为_________________。
(2)酞菁钴分子的结构简式如图甲所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1”“2”“3”或“4”),分子中三种非金属原子的电负性由大到小的顺序为____________(用相应的元素符号表示),分子中碳原子的杂化轨道类型为____________。

(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,该晶体固态下不导电,熔融状态、水溶液均能导电,该晶体属于__________(填晶体类型)。配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=__________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO__________FeO(填“>”“<”或“=”),原因是______________________________。
(5)Ni、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图乙所示,晶胞边长为apm,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
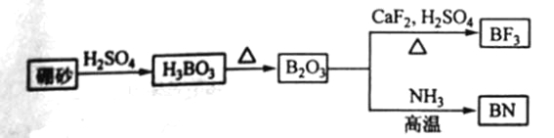
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com