
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
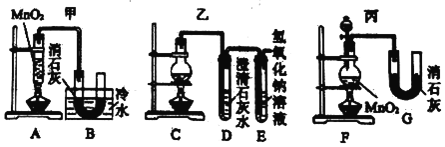
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
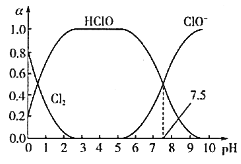
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
【答案】11.6 8.6 胶头滴管、100 mL容量瓶 偏低 无影响 偏低 甲 F B E 浓盐酸逐渐变稀,稀盐酸与二氧化锰不反应,且浓盐酸有挥发性,所以盐酸不能全部反应生成氯气,故生成的Ca(ClO)2少于0.3mol 2~6 HClO、ClO-、Cl-
【解析】
(Ⅰ)(1)根据![]() 计算浓度;
计算浓度;
(2)配制一定物质的量浓度的溶液,步骤为计算、量取、稀释、转移、洗涤、定容、摇匀、装瓶;
(Ⅱ)(1)要防止副反应的发生就要控制反应的温度。
(Ⅰ)(1)根据![]() 计算盐酸的浓度,有
计算盐酸的浓度,有![]() ;
;
(2) ①根据溶质的物质的量不变,需要量取的盐酸的体积![]() ;
;
②量取盐酸的时候需要量筒;稀释浓盐酸,需要玻璃棒、烧杯;转移时,需要100mL容量瓶,玻璃棒、烧杯;定容时,需要胶头滴管;则还需要的仪器有100mL容量瓶,胶头滴管;
③A、浓盐酸易挥发,置于烧杯后,较长时间配制,盐酸挥发,溶质减少,溶液的浓度偏低;
B、容量瓶中存在蒸馏水,由于定容前,需要往容量瓶中加入蒸馏水,因此之前存在的蒸馏水,对浓度无影响;
C、俯视刻度线,定容时,水会少加,体积偏小,浓度偏大;
(Ⅱ)(1) 氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,所以必须要控制反应温度,甲装置有冰水浴,可以较好地控制副反应的发生;
(2)F装置可以通过分液漏斗来控制反应的速率,B装置有冰水浴可以较少副反应的发生,E装置可以做到尾气吸收,答案为F B E;
(3)MnO2只与浓盐酸反应生成氯气,虽然反应的进行,浓盐酸浓度降低,不与MnO2反应,所以生成氯气的值小于理论值,答案为浓盐酸逐渐变稀,稀盐酸与二氧化锰不反应,且浓盐酸有挥发性,所以盐酸不能全部反应生成氯气,故生成的Ca(ClO)2少于0.3mol;
(Ⅲ)HClO的杀菌能力比ClO-强,所以HClO的浓度越大,杀菌效果最好,根据图像pH最好为2~6之间;当pH=7.5时,根据图像,氯水中没有Cl2,韩律的微粒有HClO、ClO-以及与水反应生成的Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】汞阴极法电解饱和食盐水制取 NaOH 的原理如下图所示。下列说法正确的是

A.电解室中反应的化学方程式为 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.解汞室中反应的离子方程式为 2Na+2H+=2Na++H2↑
C.该方法的缺点是挥发出的汞蒸气会造成环境污染
D.电解室与解汞室产生的气体可用于制取盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸不变蓝色的有( )
A.加热浓氨水
B.加热NH4HCO3固体
C.加热NH4Cl和Ca(OH)2的混合物
D.加热饱和NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
(1)CO可用于高炉炼铁。
已知:Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H=akJ·mol-1
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H=bkJ·mol-1
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H=____________kJ·mol-1(用含a、b的代数式表示)
(2)一定条件下,CO2和CO可以互相转化。某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | ωmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= ____________,该温度下反应的平衡常数K=____________。欲使平衡后乙容器与甲容器中相同气体的体积分数分别相等,则ω、x、y、z需满足的关系是y=____________,(用含x、w的代数式表示),且___________。
(3)已知反应C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:

则该反应的△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
(4)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料的中间体。由芳香化合物A制备H的一种合成路线如下:

已知:①
②![]()
回答下列问题:
(1)A的化学名称是______________,E中含有的官能团的名称为______________。
(2)B的结构简式为______________,由D到E的反应类型为______________。
(3)由E生成F的化学方程式为______________________________。
(4)G的结构简式为____________________。
(5)同时满足下列条件的F的一种同分异构体的结构简式为____________________。
①与FeCl3溶液显紫色
②能发生银镜反应
③核磁共振氢谱为五组峰,峰面积比为4:2:2:1:1
(6)设计由甲醛和乙醛为起始原料制备化合物C(CH2ONO2)4的合成路线:____________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是

A. 氧化剂与还原剂的物质的量之比为3:1
B. 该过程中涉及极性键和非极性键的断裂与生成
C. 基于![]() 合成
合成![]() 的过程属于氮的固定
的过程属于氮的固定
D. 工业中,氨经一系列反应可以得到硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究SO2的化学性质,设计了如图系列实验。

(1)①中开始时无现象,放置一段时间后,出现白色浑浊,写出有关的三个反应的化学方程式:___、___、___;
(2)③中发生反应后的铁元素的价态为___。
(3)试写出④⑤中反应的离子方程式:___、___。
(4)若通入的气体改为CO2,那么①②③④中哪个会出现与SO2不同的现象?___(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com