
【题目】汞阴极法电解饱和食盐水制取 NaOH 的原理如下图所示。下列说法正确的是

A.电解室中反应的化学方程式为 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.解汞室中反应的离子方程式为 2Na+2H+=2Na++H2↑
C.该方法的缺点是挥发出的汞蒸气会造成环境污染
D.电解室与解汞室产生的气体可用于制取盐酸
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、________________。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视__________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定 次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.00 | 24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是 _______________(填序号)。
①读数:滴定前平视,滴定后俯视②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用软锰矿(主要成分为 MnO2,含有杂质 SiO2、Fe2O3)和高品质硫锰矿(主要成 分为 MnS)制取 KMnO4 的一种工艺流程如下图所示。

请回答下列问题:
(1) “酸浸”工序中,MnO2和 MnS中的 Mn元素转化成 MnSO4,同时生成 S 单质,该反应的离子方程式为________________________________________。
(2)为了提高“酸浸”效率,下列方法可行的是_______________________。
A. 将软锰矿和硫锰矿矿石研磨成矿粉 B. 适当提高体系的温度
C. 使用浓盐酸代替稀硫酸进行酸浸 D. 使用搅拌器对混合物进行搅拌
(3)将“滤液Ⅰ”进行处理后,在温度为 50℃,pH 为 6.4~6.8 的电解槽中持续电解,可使 NaClO3复原,同时获得的副产物是 H2,则阳极的电极反应式为______________________________。
(4) “歧化”时,生成物为 K2CO3、KMnO4 和 MnO2。可通过过滤操作分离出 MnO2,并将其循环 到___________工序,以提高原料利用率。然后通过蒸发浓缩、降温结晶、过滤、洗涤、低 温 烘 干 操 作 获 得 KMnO4 固体 , 洗 涤 时 应 使 用 75% 乙 醇 溶 液 对 固 体 进 行 冲 洗 , 其 优 点是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生产、生活中都有重要的应用:

(Ⅰ)现实验室要配置一定物质的量浓度的稀盐酸。
(1)如图是某市售盐酸试剂瓶标签上的部分数据。则该盐酸的物质的量浓度是___ mol·L-1。
(2)某同学用该浓盐酸配制100mL 1mol·L-1的稀盐酸。请回答下列问题:
①通过计算可知,需要用量筒量取浓盐酸 ____ mL。
②使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______。
③若配制过程遇下列情况,溶液的物质的量浓度将会:(填“偏高”“偏低”“无影响”)
A.量取的浓盐酸置于烧杯中较长时间后配制______。
B.转移溶液前,洗净的容量瓶内壁附有水珠而未干燥处理___。
C.定容时俯视容量瓶的刻度线_____。
(Ⅱ)实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。已知:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
MnCl2 + Cl2↑+ 2H2O;氯气和氢氧化钙在温度较高时会生成副产物氯酸钙。甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
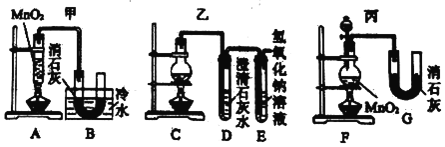
(1)哪位同学的装置能够有效地防止副反应的发生?_____。
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)_____。
(3)利用(2)中实验装置进行实验,实验中若用12 mol·L-1的浓盐酸200 mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3 mol,其可能的主要原因是_____(假定各步反应均无反应损耗且无副反应发生)。
(Ⅲ)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气一氯水体系,该体系中Cl2、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
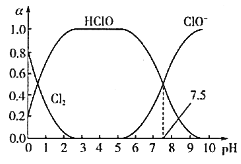
由图分析,欲使氯水的杀菌效果最好,应控制的pH范围是__,当pH=7.5时,氯水中含氯元素的微粒有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com