
【题目】某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和浓硝酸反应B.Zn和稀盐酸反应
C.Fe和稀硫酸反应D.A1和稀盐酸反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应A(s)+2B(g)===C(g)+D(g),在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 增加B的浓度
B. 将容器的体积缩小一半
C. 保持压强不变,充入He使容器体积增大
D. 保持体积不变,充入He使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
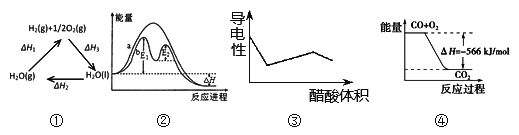
A. 图①中△H1=△H2+△H3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的导电性变化曲线
D. 图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6 mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15 mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
(1)实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是____________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
①反应后的溶液中含NH4+。实验室检验NH4+的方法是______________________________。
②生成NH4+的电极反应式是_____________________________________________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是_______________。
②A中生成NH3的离子方程式是_______________________________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实描述不正确的是
A. 高溫煅烧石灰石的反应中,反应物总能量高于生成物总能量
B. 中和反应中,反应物总能量高于生成物总能量
C. 铝粉和盐酸反应时,溶液温度通常会上升
D. 氢氧化钡晶体和氯化铵晶体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______个未成对电子,Fe3+的价电子排布式为__________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___。乙醛中碳原子的杂化轨道类型为_____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________,1 mol该物质中有______个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
B. 反应最后形成的溶液中的溶质为NaCl
C. 原溶液中一定含有Na2SO4
D. 原溶液中CO32-与AlO2-的物质的量之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com