
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氢气还原法。H2还原NO发生的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知几种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=__________kJ·mol-1
N2(g)+2H2O(g) △H=__________kJ·mol-1
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1(反应慢):2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2(反应快):H2O2(g)+H2(g)![]() 2H2O(g)
2H2O(g)
上述两步反应中,活化能较大的是反应__________(填“1”或“2”)。c(NO)对总反应速率的影响程度__________c(H2)(填“大于”“小于”或“等于”)。
II.NH3还原法。在恒容密闭容器中充入NH3和NO2;在一定温度下发生反应: 8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)
7N2(g)+12H2O(g)
(3)下列表明该反应达到平衡状态的是__________(填字母)。
A 混合气体密度保持不变 B NO2和N2的消耗速率之比为6:7
C 混合气体中c(N2)=c(NO2) D 混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应: 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
N2(g)+2CO2(g) △H。在2L恒容密闭容器中充入2 mol CO和2 mol NO,测得NO的转化率与温度、时间的关系如图所示。
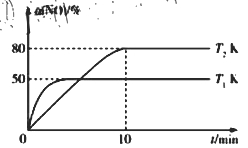
(4)下列说法正确的是_________(填字母)。
A 图像中,T1>T2 B 上述反应在高温下能自发进行
C 10min时,T2K下正、逆反应速率相等 D 增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=_________mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=_________L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2 mol N2和2 mol NO,则平衡_________(填“向右移动”“向左移动”或“不移动”)。
【答案】-666 1 大于 BD AC 0.08 1 向右移动
【解析】
(1)△H=断键吸收的总能量—成键释放的总能量,故该反应的△H=(2×630+2×436)kJ·mol-1-(946+4×463) kJ·mol-1=-666 kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),反应1:2NO(g)+H2(g)
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)
N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)![]() 2H2O(g)。总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2)。
2H2O(g)。总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2)。
(3)恒容容器中8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)
7N2(g)+12H2O(g)
A.反应前后气体总质量和总体积不变,故密度恒定不变,无法说明达到平衡,A错误;
B.反应达到平衡,正反应速率等于逆反应速率,故NO2和N2的消耗速率之比为6:7,B正确;
C.c(N2)=c(NO2)浓度相等不等于反应速率相等,C错误;
D.反应为增压反应,容器中压强不变则可证明反应达到平衡,D正确;
答案选BD。
(4)对于反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
A.由图像可知初始反应速率T1>T2,则温度T1>T2,A正确;
B. T1>T2平衡时转化率T1<T2,则ΔH<0,ΔS<0反应能自发进行![]() ;则反应在低温下能自发进行,B错误;
;则反应在低温下能自发进行,B错误;
C. 10min时反应达到平衡,T2K下正、逆反应速率相等,C正确;
D. 增大NO的浓度平衡正移,NO转化率减小,D错误;
答案选AC。
(5)T2K温度下,0~10min内,NO转化率为80%,则反应的NO物质的量为![]() ,则参与反应的CO物质的量为1.6mol
,则参与反应的CO物质的量为1.6mol![]() ;T1K温度下
;T1K温度下
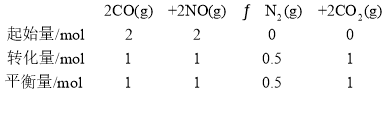
则平衡常数K=![]()
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则浓度商Q=![]() <1,故平衡正移。
<1,故平衡正移。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
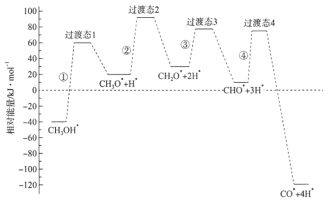
A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是③
C.该历程中制约反应速率的方程式为CH3O*+3H* CO*+4H*
D.由此历程可知:![]() △H<0
△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

A. 用装置甲制取一氯甲烷
B. 用装置乙在实验室制取氨气
C. 用装置丙萃取溴水中的溴
D. 用装置丁在实验室制蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,K接N,试回答:
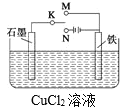
(1)石墨极为______极(填“正”、“负”、“阳” 或“阴”),铁极上的电极反应为:_______。电池总反应为:________。Cu2+向____(填“石墨”或“铁”)电极移动。
(2)若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”(主要成分为NaClO)能有效杀灭新型冠状病毒,某化学小组对“84消毒液”的制备和性质进行研究。请回答下列问题:
I.甲同学查阅资料知道可以利用氯气与氢氧化钠溶液反应制取“84消毒液”,同时发现“在加热情况下卤素与碱液发生如下反应:3X2+6OH-→5X-+XO3-+3H2O”。由此设计了如下装置。
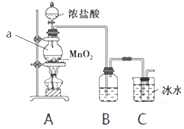
(1)仪器a的名称为__________,B中所用试剂为__________。
(2)A中发生反应的离子方程式为________。
(3)有同学认为该实验存在明显的缺陷,如何改进:________。
II.乙同学阅读某“84消毒液”的包装说明得到以下信息:
严禁与洁厕灵(主要成分盐酸)同时使用。
有效氯含量在5%以上。
有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征。
(1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,写出反应的离子方程式___。
(2)乙同学进行如下实验测定有效氯:
步骤一:取C中大试管溶液5 g于锥形瓶,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液。
步骤二:用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
步骤一反应的离子方程式为________。通常选用__________作指示剂,滴定至终点的现象________。此消毒液有效氯含量为__________%(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________,HClO分子中中心原子的杂化轨道类型为__________。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________。
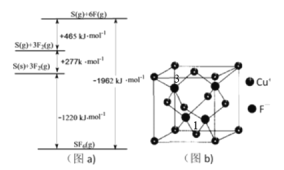
(3)①与Cl相邻的元案S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________。
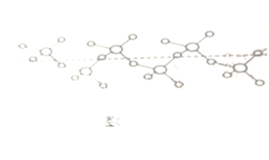
②硫和氧形成的链状化合物结构如图(C),其化学式为__________。
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________,写出一种与配体互为等电子体的阳离子的电子式__________。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加德罗常数的值,则CuF晶体的密度为______g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(![]() ,
,![]() ,0),则离子3的坐标为__________。
,0),则离子3的坐标为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用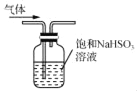 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
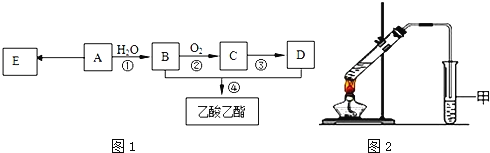
(1)A分子中官能团的名称是______,D中官能团的名称是______;反应①的反应类型是______反应.
(2)反应②的化学方程式是______,反应④的化学方程式是______.
(3)E是常见的高分子材料,合成E的化学方程式是______.
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的目的是______.
②上述实验中饱和碳酸钠溶液的作用是(填字母)______.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.50 mL 1.0mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
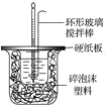
(1)___(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是__(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__(填“增加”“减少”或“不变”);所求中和热数值__(填“增加”“减少”或“不变”)。
(4)__(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 g·cm-3,中和后混合液的比热容c=4.184×10﹣3kJ·g-1·℃-1则该反应的中和热为ΔH=__(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是__(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
II. 草酸与高锰酸钾在酸性条件下能够发生反应:
现用 0.1 mol/L KMnO4酸性溶液与0.5 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录 (见表格),请结合表中信息,回答有关问题:
实验 序号 | 反应温度/℃ | 参加反应的物质 | |||||
KMnO4(H2SO4) | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 10 | 0.5 | 0 | 0 | |
(1)写出反应的化学方程式____________________________________;
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用A~E表示,下同)
(3)如果研究温度对化学反应速率的影响,使用实验________和________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com