
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
| 待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管 a 相比,变深。 |
已知:![]() (aq)(橙色) + H2O(l)2
(aq)(橙色) + H2O(l)2![]() (aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
A.该反应为氧化还原反应
B.待试管 b 中溶液颜色不变的目的是使![]() 完全反应
完全反应
C.试管c中的现象说明影响平衡的主要因素是温度
D.该实验不能证明减小生成物浓度平衡正向移动
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__________
(1)配平以上离子方程式,并在![]() 中填上所需的微粒或数字。
中填上所需的微粒或数字。
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是__。
②溶解沉淀时__(能或不能)用稀盐酸,原因是___。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 的密闭容器中,放入镍粉并充入
的密闭容器中,放入镍粉并充入![]() 定量的CO气体,一定条件下发生反应:
定量的CO气体,一定条件下发生反应:![]() ,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是
,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是![]()
![]()
温度 | 25 | 80 | 230 |
平衡常数 |
| 2 |
|
A.上述生成Ni![]()
![]() 的反应为吸热反应
的反应为吸热反应
B.![]() 时反应Ni
时反应Ni![]()
![]() 的平衡常数为
的平衡常数为![]()
C.在![]() 时,测得某时刻,
时,测得某时刻,![]() 、CO浓度均
、CO浓度均![]()
![]() ,则此时
,则此时![]()
D.![]() 达到平衡时,测得
达到平衡时,测得![]() 3mol,则
3mol,则![]() 的平衡浓度为2
的平衡浓度为2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
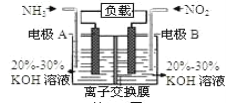
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
D.电极A极反应式为2NH3-6e-=N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是( )
A.0.2 mo1CO2通入1L 0.3molL-1 KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-)
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.常温下pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D.已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。请回答下列问题:
(1)下列物质与A以任意比例混合,只要总物质的量一定,充分燃烧消耗氧气的量不变的是(填字母)________。
a.C7H12O2b.C6H14 c.C6H14O d.C7H14O3
(2)若A是链烃且分子中所有的碳原子共平面,该分子的一氯取代物只有一种,则A的结构简式为__________________。
(3)若A是链烃且其1H核磁共振谱有三组不同的峰,峰值比为3∶2∶1,则A的名称为__________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应 2SO2+O2![]() 2SO3 的化学反应速率,其中表示该反应进行得最快的是( )
2SO3 的化学反应速率,其中表示该反应进行得最快的是( )
A.v (SO3)=4mol/(L·min)B.v (O2)=6mol/(L·min)
C.v (SO2)=8mol/(L·min)D.v (O2)=3mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com