
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | 900 | a | b | c | d | t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.8mol/L |
| 5min |
| 0.8×0.8 |
| 1.2×0.2 |
| 0.2×0.2 |
| 0.8×0.3 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: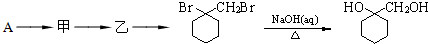 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| △ |

 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com