
【题目】符合下图所示条件的离子组是( )

A. Ba2+、Mg2+、NO3-、CO32-B. H+、Ba2+、Al3+、Cl-
C. K+、Ba2+、Cl-、HCO3-D. NH4+、Ba2+、Fe2+、Cl-
【答案】C
【解析】
首先判断出可以大量共存的离子组,即相互之间不发生氧化还原反应,不生成沉淀、气体或水等;加入少量的H2SO4有白色沉淀产生且不溶解,则溶液中可能存在Ba2+、Pb2+、Ca2+等;加入过量NaOH溶液有白色沉淀生成且不溶解,则不能为Al(OH)3,可能为Mg(OH)2等难溶性碱;或者与HCO3-反应产生CO32-,在溶液中形成的难溶性的碳酸盐。据此回答。
A. Ba2+和CO32-生成BaCO3沉淀,不能大量共存;故A错误;
B.离子可以大量共存,加入少量H2SO4,因生成BaSO4而产生白色沉淀,但加入过量NaOH溶液时,溶液中无白色沉淀产生,不符合题意,故B错误;
C.离子可以大量共存,加入少量H2SO4,生成BaSO4白色沉淀,加入过量NaOH溶液时,HCO3-+OH-= CO32-+H2O,CO32-和Ba2+反应产生BaCO3沉淀,符合题意,故C正确;
D.离子可以大量共存,加入少量H2SO4,生成BaSO4白色沉淀,但加入过量NaOH溶液时生成的Fe(OH)2很快被氧化成红褐色的Fe(OH)3,最终得不到白色沉淀,不符合题意,故D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
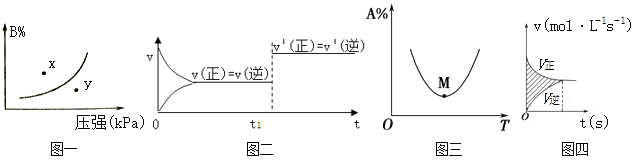
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
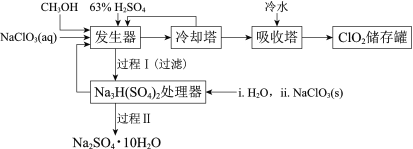
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
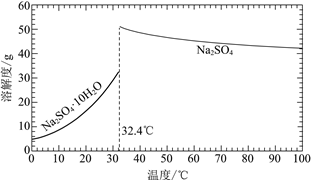
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤粉中的氮元素在使用过程中的转化关系如图所示:

(1)②中NH3参与反应的化学方程式为_______。
(2)焦炭氮中有一种常见的含氮有机物吡啶(![]() ),其分子中相邻的C和N原子相比,N原子吸引电子能力更___________(填“强”或“弱”),从原子结构角度解释原因:________。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更___________(填“强”或“弱”),从原子结构角度解释原因:________。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:
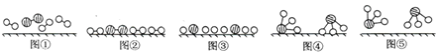
下列说法正确的是________(选填字母)。
a. 图①表示N2、H2分子中均是单键
b. 图②→图③需要吸收能量
c. 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g) + O2(g) = 2NO(g) ΔH = a kJ·mol-1
N2(g) + 3H2(g) = 2NH3(g) ΔH = b kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH = c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为________。
(5)用间接电化学法除去NO的过程,如图所示:

①已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:________。
②用离子方程式表示吸收池中除去NO的原理:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32-
B. 澄清透明溶液:Mg2+、Cu2+、Cl-、SO42-
C. 使酚酞变红色的溶液:NH4+、K+、AlO2-、SO32-
D. 含0.1 mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
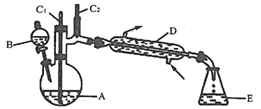
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
![]()
![]()
![]()
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g·cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式__________;
②蒸馏不能分离环己酮和水的原因是____________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____________;
②b中水层用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaCl固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等.工业上用铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1)氧化炉中Al2O3、Cl2和C反应的化学方程式______.
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式______.
(3)为了测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,再洗涤、灼烧、冷却、称重、得其质量为0.32g。
①写出上述测定过程中涉及的离子方程式:______、__________。
②AlCl3产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
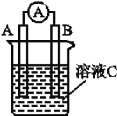
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com