
【题目】以有机化合物A为初始原料,合成有机化合物C和F的路线如图所示:
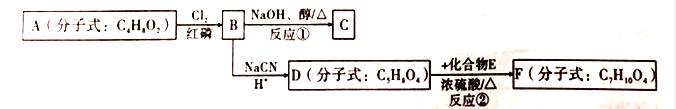
已知以下信息:
①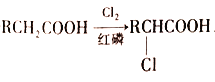 ,R-Cl
,R-Cl![]() R—COOH,其中R表示烃基;
R—COOH,其中R表示烃基;
②D的核磁共振氢谱有两种不同化学环境的氢;
③F为七元环状化合物。
回答下列问题:
(1)A中含有的官能团名称为________;1molA完全燃烧消耗O2________mol.
(2)判断反应类型:反应①为_________;反应②为_________。
(3)E的结构简式为_________;F的结构简式为_________。
(4)由B生成C的化学方程式为_________。
(5)请写出满足下列条件的D的2种链状同分异构体的结构简式: _________。
①可发生水解反应;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3。
(6)利用该合成路线中的有关信息,写出以乙醇为初始原料,其他无机试剂任选,制备有机化合物CH2=CHCOOH的合成路线流程图:(流程图示例:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C—CH2Br)________________
BrH2C—CH2Br)________________
【答案】 羧基 5 消去反应 酯化反应(或取代反应) ![]()
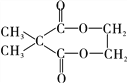
![]()
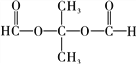 、
、![]()
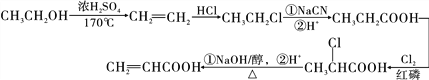
【解析】结合已知条件,D的核磁共振氢谱有两种不同化学环境的氢,D结构高度对称且含有羧基,羧基中有一种氢,则D的结构简式为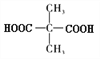 ,则B为
,则B为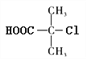 ,A为
,A为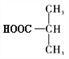 ;
; 在氢氧化钠的醇溶液中加热发生消去反应生成C为
在氢氧化钠的醇溶液中加热发生消去反应生成C为![]() ;
; 与化合物E在浓硫酸催化下发生酯化反应生成七元环状化合物F,根据F的分子式可推知F为
与化合物E在浓硫酸催化下发生酯化反应生成七元环状化合物F,根据F的分子式可推知F为 ;则E为
;则E为![]() 。(1)A为
。(1)A为 ,含有的官能团名称为羧基;A的分子式为C4H8O2,根据有机物CxHyOz耗氧x+
,含有的官能团名称为羧基;A的分子式为C4H8O2,根据有机物CxHyOz耗氧x+![]() -
-![]() 计算可知,1molA完全燃烧消耗O2(4+
计算可知,1molA完全燃烧消耗O2(4+![]() )mol=5mol;(2)反应①为
)mol=5mol;(2)反应①为 在氢氧化钠的醇溶液中加热发生消去反应生成
在氢氧化钠的醇溶液中加热发生消去反应生成![]() ;反应②为
;反应②为 与
与![]() 在浓硫酸催化下发生酯化反应,也属于取代反应;(3)E的结构简式为
在浓硫酸催化下发生酯化反应,也属于取代反应;(3)E的结构简式为![]() ;F的结构简式为
;F的结构简式为 ;(4)由
;(4)由![]() ;(5)满足下列条件的D的链状同分异构体:①可发生水解反应,则应该为酯;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3,则高度对称,则应该为两个甲基,则结构简式为
;(5)满足下列条件的D的链状同分异构体:①可发生水解反应,则应该为酯;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3,则高度对称,则应该为两个甲基,则结构简式为 、
、![]() ;(6)根据流程图示例:CH3CH2OH
;(6)根据流程图示例:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C—CH2Br,结合题干信息RCH2COOH
BrH2C—CH2Br,结合题干信息RCH2COOH![]()
![]() ,R—Cl
,R—Cl![]() R—COOH,以及合成路线中的相关信息完成以乙醇为初始原料,制备CH2=CHCOOH的合成路线流程图如下:
R—COOH,以及合成路线中的相关信息完成以乙醇为初始原料,制备CH2=CHCOOH的合成路线流程图如下: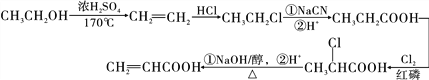 。
。


科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是(已知硝酸可将Fe2+氧化)( )
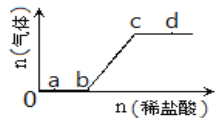
A. a点对应的溶液中:Na+、OH-、SO42-、NO3- B. b点对应的溶液中:K+、Ag+、MnO4-、NO3-
C. c点对应的溶液中:Fe2+、Ca2+、NO3-、Cl- D. d点对应的溶液中:K+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 9gD2O中含有的电子数为5NA
B. 氢氧化铁胶体带正电荷。用含0.1mol的FeCl3溶液制成的氢氧化铁胶体中,胶粒数小于0.1NA
C. 常温下,7.8gNa2O2与100mL0.05mol/L的HCl溶液反应,产生的气体体积大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物质的量之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“高铁出口”是中国的骄傲,高铁产业的发展也给铝工业带来了春天。最近,某大学的超导回旋加速器实验室发现了超重铝42Al,关于42Al的说法错误的是
A.属于金属元素B.中子数与质子数之差为29
C.原子的核外电子数为13D.27Al和42Al是两种不同的核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
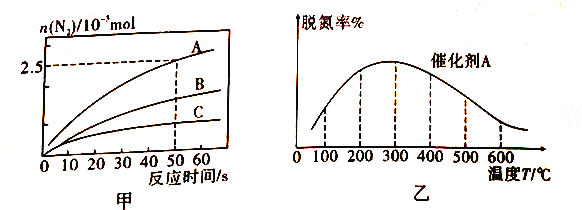
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
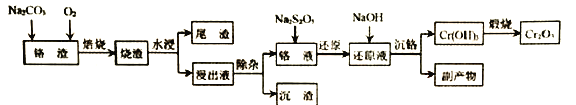
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。

下列说法不正确的是:
A. 气体A一定是混合气体
B. 沉淀A一定是H2SiO3
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 该固体混合物一定含有Fe、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基磺酸镍[Ni(H2NSO3)2]是工业电镀镍所必需的化工原料,某科研小组先用尿素、SO3合成中间体氨基磺酸(H2NSO3H),再用氨基磺酸、金属镍和双氧水反应来合成氨基磺酸镍。已知磺化制氨基磺酸反应原理和整个过程的流程图如下:
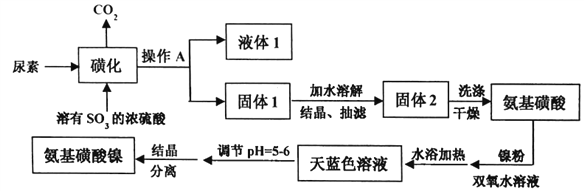
①CO(NH2)2(s)+SO3(g)→H2NCONHSO3H(s) △H<0
②H2NCONHSO3H (s)+ H2SO4→2H2NSO3H (s)+ CO2↑
已知物质的部分性质如下:
物质 | 溶解性 | 稳定性 | 酸碱性 |
氨基磺酸 | 溶于水、不溶于乙醇 | pH较低时发生水解生成NH4HSO4 | 强酸性 |
氨基磺酸镍 | 溶于水、乙醇 | 高于110℃时分解 | 酸性 |
请回答
(1)操作A的名称是_________液体1的主要成分是_______(填化学式)。
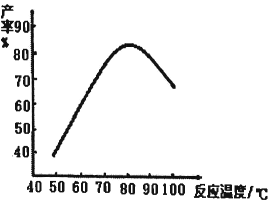
(2)“磺化”过程的温度与产率的关系如下图。温度高于80℃时氨基磺酸的产率会降低,原因一是升高温度平衡逆向移动,原因二是__________。
(3)写出制备氨基磺酸镍的化学方程式____________________。
(4)写出固体2洗涤的操作过程___________________。
(5)流程图中“天蓝色溶液”需要调节pH=5~6的原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com