
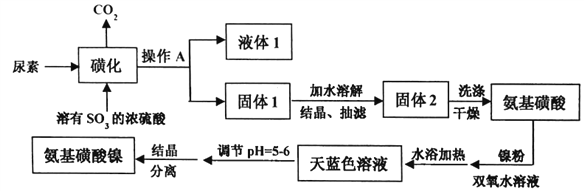
【题目】氨基磺酸镍[Ni(H2NSO3)2]是工业电镀镍所必需的化工原料,某科研小组先用尿素、SO3合成中间体氨基磺酸(H2NSO3H),再用氨基磺酸、金属镍和双氧水反应来合成氨基磺酸镍。已知磺化制氨基磺酸反应原理和整个过程的流程图如下:
①CO(NH2)2(s)+SO3(g)→H2NCONHSO3H(s) △H<0
②H2NCONHSO3H (s)+ H2SO4→2H2NSO3H (s)+ CO2↑
已知物质的部分性质如下:
物质 | 溶解性 | 稳定性 | 酸碱性 |
氨基磺酸 | 溶于水、不溶于乙醇 | pH较低时发生水解生成NH4HSO4 | 强酸性 |
氨基磺酸镍 | 溶于水、乙醇 | 高于110℃时分解 | 酸性 |
请回答
(1)操作A的名称是_________液体1的主要成分是_______(填化学式)。
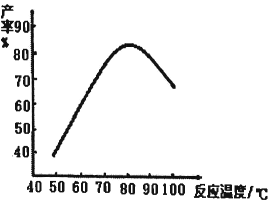
(2)“磺化”过程的温度与产率的关系如下图。温度高于80℃时氨基磺酸的产率会降低,原因一是升高温度平衡逆向移动,原因二是__________。
(3)写出制备氨基磺酸镍的化学方程式____________________。
(4)写出固体2洗涤的操作过程___________________。
(5)流程图中“天蓝色溶液”需要调节pH=5~6的原因是___________。
【答案】 过滤或抽滤 H2SO4 温度过高,SO3气体逸出加快,使反应①转化率降低 Ni+H2O2+ 2H2NSO3H=Ni(H2NSO3)2+2H2O 关小水龙头,向布氏漏斗中加入乙醇的水溶液至浸没沉淀,让其慢慢流下,重复2~3次 pH较小时氨基磺酸易发生水解,产物中含有NiSO4、(NH4)2SO4等杂质,酱成产物纯度降低
【解析】(1)操作A是用来分离固体和液体,名称是过滤或抽滤;根据方程式①CO(NH2)2(s)+SO3(g)→H2NCONHSO3H(s) 和②H2NCONHSO3H (s)+ H2SO4→2H2NSO3H (s)+ CO2↑可知通过操作A后得到的液体1的主要成分是H2SO4。答案为:过滤或抽滤 、 H2SO4
(2) “磺化”步骤中所发生的反应为:
①CO(NH2)2(s)+SO3(g)H2NCONHSO3H(s)△H<0
②H2NCONHSO3H+H2SO42H2NSO3H+CO2↑, “磺化“过程若温度高于80℃,氨基磺酸的产率会降低,原因是温度越高,三氧化硫气体逸出速率加快,且CO(NH2)2(s)+SO3(g)H2NCONHSO3H(s)是放热反应,升高温度,平衡向逆反应方向移动,从而抑制氨基磺酸的产率。答案为:温度过高,SO3气体逸出加快,使反应①转化率降低
(3)氨基磺酸与镍粉和双氧水反应可以制得氨基磺酸镍,化学方程式是Ni+H2O2+ 2H2NSO3H=Ni(H2NSO3)2+2H2O答案为:Ni+H2O2+ 2H2NSO3H=Ni(H2NSO3)2+2H2O
(4)根据表中已知物质的部分性质可知:氨基磺酸溶于水、不溶于乙醇,可以选择用乙醇洗涤。洗涤固体2的操作是:关小水龙头,向布氏漏斗中加入乙醇的水溶液至浸没沉淀,让其慢慢流下,重复2~3次。答案为:关小水龙头,向布氏漏斗中加入乙醇的水溶液至浸没沉淀,让其慢慢流下,重复2~3次
(5)根据表中已知物质的部分性质可知:氨基磺酸在pH较低时易发生水解 ,使产物的纯度降低,因此需要调节pH。答案为:pH较小时氨基磺酸易发生水解,产物中含有NiSO4、(NH4)2SO4等杂质,使产物纯度降低。


科目:高中化学 来源: 题型:
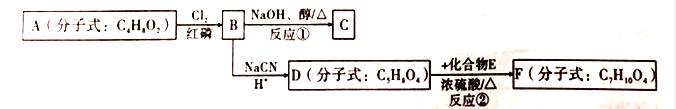
【题目】以有机化合物A为初始原料,合成有机化合物C和F的路线如图所示:
已知以下信息:
①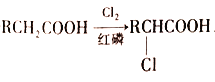 ,R-Cl
,R-Cl![]() R—COOH,其中R表示烃基;
R—COOH,其中R表示烃基;
②D的核磁共振氢谱有两种不同化学环境的氢;
③F为七元环状化合物。
回答下列问题:
(1)A中含有的官能团名称为________;1molA完全燃烧消耗O2________mol.
(2)判断反应类型:反应①为_________;反应②为_________。
(3)E的结构简式为_________;F的结构简式为_________。
(4)由B生成C的化学方程式为_________。
(5)请写出满足下列条件的D的2种链状同分异构体的结构简式: _________。
①可发生水解反应;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3。
(6)利用该合成路线中的有关信息,写出以乙醇为初始原料,其他无机试剂任选,制备有机化合物CH2=CHCOOH的合成路线流程图:(流程图示例:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C—CH2Br)________________
BrH2C—CH2Br)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73g氯化氢(HCl)气体,则:
(1)该气体的摩尔质量为_____________。
(2)该气体的物质的量为________ ,所含分子总数为___________________个。
(3)该气体在标准状况下的体积为_____________L。
(4)将73g氯化氢(HCl)气体溶于水配成2L溶液,所得盐酸的物质的量浓度为__________。
(5)在标准状况下,测得1.92g某气体的体积为672ml,计算此气体的相对分子质量__________。
(6)N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为_______,同温同压下体积比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制得的NaHCO3固体中含有部分Na2CO3·nH2O(n<10)。取该固体8.50g充分加热,产生的气体依次通过浓硫酸(增重1.44 g)和碱石灰(增重1.76 g)。
请计算:
(1)固体中NaHCO3的质量为_________g。
(2)固体中Na2CO3·nH2O的n值为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6.5g Zn在与足量盐酸反应时产生的H2 在标准状况下的体积是多少升?
__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂(用化学式表示),元素被氧化(用符号表示),HCl表现的性质是、 , 电子转移的数目是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)请用离子方程式表示纯碱溶液呈碱性的原因:_____________________________。
(2)请用离子方程式表示明矾净水的原理:_____________________________。
(3)请用化学方程式表示氯碱工业的反应原理:_____________________________。
(4)请用化学方程式表示铝热法炼铁的反应原理:_____________________________。
(5)将AlCl3溶液蒸干并灼烧,最后得到的主要固体产物是_______________。
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+ )=c(Cl-),则溶液显_________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com