
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
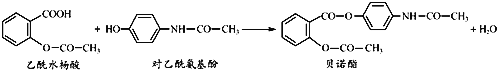
下列有关叙述正确的是
A.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应放出CO2气体
D.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出这五种元素的名称。A___,B__,C__,D___,E__。
(2)写出D元素单质的结构式:___。
(3)写出下列物质的电子式:
E与B形成的化合物:__;A、B、E形成的化合物:__;D、E形成的化合物:___。
(4)A、B两元素组成的化合物A2B2属于___(填“离子”或“共价”)化合物,存在的化学键是___。写出A2B2与水反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分:
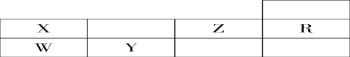
(1)判断X __________ Y __________ Z __________W__________R ________(写元素符号)。
(2)写出X的氢化物的化学式;__________,W的氢化物的化学式__________,其沸点比较:__________>________(填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布图是因为它不符合________。
①![]()
②![]()
(4)以上五种元素中,________(填元素符号)元素第一电离能最大。__________元素电负性最大,Y的基态原子的电子排布式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室配制90mL 1 mol·L-1的NaOH溶液:
(1)用托盘天平称量NaOH的质量为________g。
(2)配制该溶液时需用的主要仪器有烧杯、玻璃棒、胶头滴管、_______________等。
(3)误差下列情况使配制结果偏大的是________。
A.溶解后未冷却即转移、定容
B.定容时仰视容量瓶刻度线
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切
D.托盘天平砝码生锈
E.容量瓶内残有少量蒸馏水
Ⅱ. 某同学学习了铁及其化合物的性质,欲设计实验研究铁及其化合物的部分性质。
(1)该同学根据下图装置做相关实验,请回答下列问题:
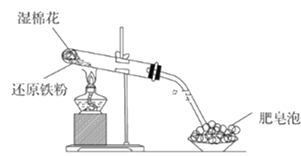
①硬质试管中发生反应的化学方程式为_______________。
②该同学将硬质试管冷却后的少量固体物质溶于稀盐酸得溶液A,向溶液A中滴加KSCN溶液,若溶液未变红色,原因是:________________(用离子方程式表示)。
③该同学向溶液A中滴入一定量的氯水,用该所得溶液腐蚀刻铜板制电路板的主要反应离子方程式___________。
(2)该同学用如下图所示装置制取Fe(OH)2,实验时使用铁屑、6 mol/L硫酸,其他试剂任选。回答下列问题:
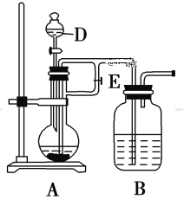
向仪器D中需要放入硫酸,装置B中盛有一定量的NaOH溶液,A中盛有铁屑,实验开始时应先将活塞E打开,待装置中空气排尽后,将活塞E关闭,一段时间后能够长时间观察到装置B中的白色沉淀原因是_____;待A中停止反应后,观察到装置B的白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,写出B中出现该现象的反应方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
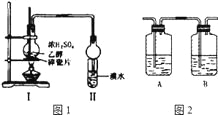
(1)写出该实验中生成乙烯的化学方程式: _______
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 (填字母序号)
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是____________
(4)丙同学对上述实验装置进行了改进,在I和II之间增加如图2装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________
(5)处理上述实验后烧瓶中废液的正确方法是 (填字母序号)
A.废液冷却后倒入下水道中
B.废液冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4;C4H10→CH4+C3H6;某化学兴趣小组的同学为测定丁烷裂解气中CH4的物质的量,设计实验如图所示:

(注:CuO能将烃氧化成CO2和H2O; Al2O3是催化剂,G后面装置已省略。)
如图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是: 。
(2)B装置所起的作用是 。
(3)写出C2H6在G中的化学方程式: 。
(4)实验室中对E装置中的混和物按下图操作:
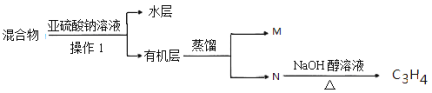
①操作I中用到玻璃仪器是 ,写出M的分子式 。
②亚硫酸钠溶液的作用是(用离子方程式表示) 。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应,当(E和F)装置的总质量比反应前增加了15.4g,G装置中固体质量减少了30.4g,则丁烷的裂解产物中n(CH4)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com