
【题目】下表为元素周期表前三周期的一部分:
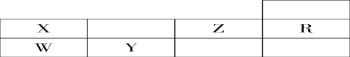
(1)判断X __________ Y __________ Z __________W__________R ________(写元素符号)。
(2)写出X的氢化物的化学式;__________,W的氢化物的化学式__________,其沸点比较:__________>________(填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布图是因为它不符合________。
①![]()
②![]()
(4)以上五种元素中,________(填元素符号)元素第一电离能最大。__________元素电负性最大,Y的基态原子的电子排布式为__________
【答案】N S F P Ne NH3 PH3 NH3 PH3 洪特规则 Ne F 1s22s22p63s23p4
【解析】
根据元素在元素周期表的位置可以分析,X为N元素,W为P元素,Y为S元素,R为Ne元素,Z为F元素,据此回答。
(1)根据分析,5种元素依次是N、S、F、P、Ne;
(2)X的氢化物的化学式为NH3,W的氢化物的化学式为PH3,因NH3中含有氢键,故NH3的沸点较高;
(3)图中①的基态原子电子排布图错误,因为它不符合洪特规则,洪特规则表明基态原子电子排布时应优先分占不同的轨道且自旋方向相同;
(4)以上五种元素中,Ne元素第一电离能最大,F元素电负性最大,Y的基态原子的电子排布式为1s22s22p63s23p4。


科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
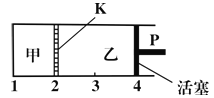
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活等方面有广泛的应用。
(1)铝元素位于周期表中第________周期________族。硼、镓与铝位于同一主族,现有下列三种物质:①NaAlO2、②NaBO2、③NaGaO2,浓度相同的这三种物质的溶液pH由大到小的顺序为________(用序号表示)。
(2)将20.0 mL 0.1 mol·L-1 Ba(OH)2溶液和20.0 mL 0.1 mol·L-1 NH4Al(SO4)2溶液混合,所得溶液中Al3+、NH![]() 、SO
、SO![]() 、OH-、H+的浓度由大到小的顺序为________________________。
、OH-、H+的浓度由大到小的顺序为________________________。
(3)氮化铝(AlN)是一种新型的无机非金属材料,可用作热交换器材料。某AlN样品中仅含有Al2O3杂质,为测定AlN的含量,甲组同学设计了如下流程:

已知:AlN+NaOH+H2O=NaAlO2+NH3↑。
①过滤时用到的玻璃仪器有烧杯、漏斗和________。
②实验过程中,称得样品的质量为4.2 g,最后得到的固体为5.1 g,则样品中AlN的质量分数为________。(不考虑整个过程中的损耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
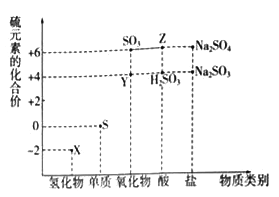
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
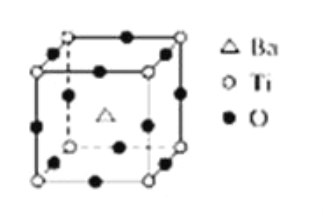
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() 的溶液中:K+、Na+、CO32-、NO3-
的溶液中:K+、Na+、CO32-、NO3-
B.澄清透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
C.c(Fe2+)=1 mol/L的溶液中: Na+、NH4+、AlO2-、SO42-
D.能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
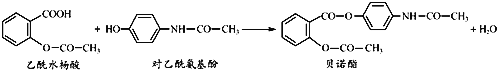
下列有关叙述正确的是
A.贝诺酯分子中有三种含氧官能团
B.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应放出CO2气体
D.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com