
【题目】铝及其化合物在生产、生活等方面有广泛的应用。
(1)铝元素位于周期表中第________周期________族。硼、镓与铝位于同一主族,现有下列三种物质:①NaAlO2、②NaBO2、③NaGaO2,浓度相同的这三种物质的溶液pH由大到小的顺序为________(用序号表示)。
(2)将20.0 mL 0.1 mol·L-1 Ba(OH)2溶液和20.0 mL 0.1 mol·L-1 NH4Al(SO4)2溶液混合,所得溶液中Al3+、NH![]() 、SO
、SO![]() 、OH-、H+的浓度由大到小的顺序为________________________。
、OH-、H+的浓度由大到小的顺序为________________________。
(3)氮化铝(AlN)是一种新型的无机非金属材料,可用作热交换器材料。某AlN样品中仅含有Al2O3杂质,为测定AlN的含量,甲组同学设计了如下流程:

已知:AlN+NaOH+H2O=NaAlO2+NH3↑。
①过滤时用到的玻璃仪器有烧杯、漏斗和________。
②实验过程中,称得样品的质量为4.2 g,最后得到的固体为5.1 g,则样品中AlN的质量分数为________。(不考虑整个过程中的损耗)
【答案】三 ⅢA ③>①>② c(SO42)>c(NH4+)>c(Al3+)>c(H+)>c(OH) 玻璃棒 97.62%
【解析】
(1)对于主族元素,周期数=电子层数,族序数=最外层电子数.据此判断该元素在周期表中位置;根据同主族元素原子序数越大,金属性越强,其对应的盐碱性越强;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,即两者等物质的量混合,生成2mmol的硫酸钡和![]() mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和
mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和![]() mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性;
mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性;
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1N~A12O3,由关系式求氮化铝的质量,然后代入质量分数进行计算。
(1)原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;同主族元素原子序数越大,金属性越强,其对应的盐溶液碱性越强,镓、硼与铝位于同一主族,金属性:镓>铝>硼,故碱性:③>①>②,
故答案为:三;ⅢA;③>①>②;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/LNH4A1(SO4)2溶液混合,即两者等物质的量混合,所以2mmol的硫酸钡和![]() mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和
mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和![]() mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性,所以离子浓度的大小为:c(SO42)>c(NH4+ )>c(Al3+)>c(H+)>c(OH);
mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性,所以离子浓度的大小为:c(SO42)>c(NH4+ )>c(Al3+)>c(H+)>c(OH);
故答案为:c(SO42)>c(NH4 +)>c(Al3+)>c(H+)>c(OH);
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒;
故答案为:玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1NA12O3,
2×(27+14) 102
m(A1N) 5.1g
所以![]() =
=![]() ,解之得:m(A1N)=4.1g,则样品中A1N的质量分数为
,解之得:m(A1N)=4.1g,则样品中A1N的质量分数为 ![]() ×100%=97.62%;
×100%=97.62%;
故答案为:97.62%。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)当有1mol氧化剂参与反应时,转移电子的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为2 L的两个恒容密闭容器中分别充入1mol SiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )

A.T1<T2
B.T1℃时,0~100min反应的平均速率υ(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=1/64
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出这五种元素的名称。A___,B__,C__,D___,E__。
(2)写出D元素单质的结构式:___。
(3)写出下列物质的电子式:
E与B形成的化合物:__;A、B、E形成的化合物:__;D、E形成的化合物:___。
(4)A、B两元素组成的化合物A2B2属于___(填“离子”或“共价”)化合物,存在的化学键是___。写出A2B2与水反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH![]() 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。

则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO![]() ,可能含有SO
,可能含有SO![]() 和NO
和NO![]()
C.溶液中n(NH![]() )=0.2 mol
)=0.2 mol
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
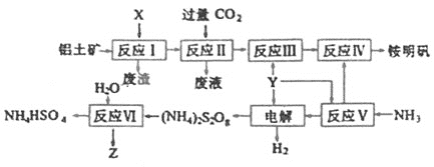
(1)写出反应Ⅱ的离子方程式________。
(2)从反应IV的铵明矾溶液中获得铵明矾晶体的实验操作依次为________、________、过滤、洗涤(填操作名称)。
(3)反应Ⅵ的化学方程式为________。
(4)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应路线及所给信息填空。
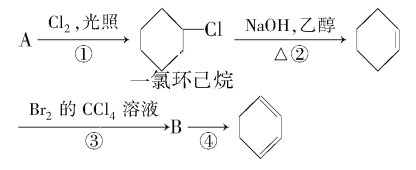
(1)A的结构简式是________。
(2)①②的反应类型分别是_______,②的反应方程式是_________。
(3)反应③的化学方程式是________。
(4)反应④的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前三周期的一部分:
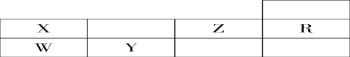
(1)判断X __________ Y __________ Z __________W__________R ________(写元素符号)。
(2)写出X的氢化物的化学式;__________,W的氢化物的化学式__________,其沸点比较:__________>________(填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布图是因为它不符合________。
①![]()
②![]()
(4)以上五种元素中,________(填元素符号)元素第一电离能最大。__________元素电负性最大,Y的基态原子的电子排布式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com