
【题目】根据反应路线及所给信息填空。
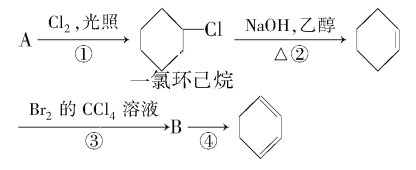
(1)A的结构简式是________。
(2)①②的反应类型分别是_______,②的反应方程式是_________。
(3)反应③的化学方程式是________。
(4)反应④的化学方程式是________。
【答案】![]() 取代反应,消去反应
取代反应,消去反应 ![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O
+NaCl+H2O ![]() +Br2→
+Br2→![]()
![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O
+2NaBr+2H2O
【解析】
由合成路线可知,反应①为光照条件下的取代反应,所以A为![]() ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,则B为![]() ,反应④为卤代烃的消去反应,生成环己二烯,结合物质的性质及化学用语来解答。
,反应④为卤代烃的消去反应,生成环己二烯,结合物质的性质及化学用语来解答。
(1)由上述分析可知,A为环己烷,其结构简式为为![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应①为取代反应,②为消去反应,反应②是一氯环己烷发生卤代烃的消去反应生成环己烯,反应化学方程式为:![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O,故答案为:取代反应;消去反应;
+NaCl+H2O,故答案为:取代反应;消去反应;![]() +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
(3)反应③为环己烯的加成反应,反应方程式为![]() +Br2→
+Br2→![]() ,反应④是卤代烃在氢氧化钠醇溶液、加热条件下发生的消去反应,反应方程式为:
,反应④是卤代烃在氢氧化钠醇溶液、加热条件下发生的消去反应,反应方程式为:![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O,故答案为:
+2NaBr+2H2O,故答案为:![]() +Br2→
+Br2→![]() ;
;![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有 X、Y、Z、W 四种物质,此温度下发生反应的平衡常数表达式如右:![]() 。有关该平衡体系的说法正确的是 ( )
。有关该平衡体系的说法正确的是 ( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活等方面有广泛的应用。
(1)铝元素位于周期表中第________周期________族。硼、镓与铝位于同一主族,现有下列三种物质:①NaAlO2、②NaBO2、③NaGaO2,浓度相同的这三种物质的溶液pH由大到小的顺序为________(用序号表示)。
(2)将20.0 mL 0.1 mol·L-1 Ba(OH)2溶液和20.0 mL 0.1 mol·L-1 NH4Al(SO4)2溶液混合,所得溶液中Al3+、NH![]() 、SO
、SO![]() 、OH-、H+的浓度由大到小的顺序为________________________。
、OH-、H+的浓度由大到小的顺序为________________________。
(3)氮化铝(AlN)是一种新型的无机非金属材料,可用作热交换器材料。某AlN样品中仅含有Al2O3杂质,为测定AlN的含量,甲组同学设计了如下流程:

已知:AlN+NaOH+H2O=NaAlO2+NH3↑。
①过滤时用到的玻璃仪器有烧杯、漏斗和________。
②实验过程中,称得样品的质量为4.2 g,最后得到的固体为5.1 g,则样品中AlN的质量分数为________。(不考虑整个过程中的损耗)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,该有机物能发生( )
,该有机物能发生( )
①取代反应,②加成反应,③消去反应,④使溴水褪色,⑤使酸性KMnO4溶液褪色,⑥与AgNO3溶液生成白色沉淀,⑦聚合反应
A.以上反应均可发生B.只有⑦不能发生
C.只有⑥不能发生D.只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
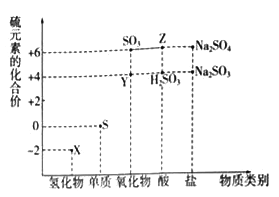
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
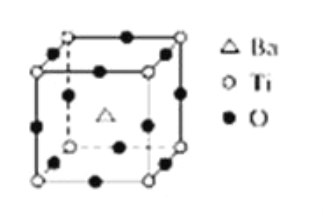
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() 的溶液中:K+、Na+、CO32-、NO3-
的溶液中:K+、Na+、CO32-、NO3-
B.澄清透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
C.c(Fe2+)=1 mol/L的溶液中: Na+、NH4+、AlO2-、SO42-
D.能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
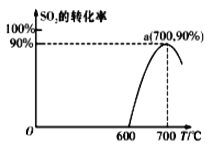
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com