
ЁОЬтФПЁПяЇУїЗЏ[NH4Al(SO4)2ЁЄ12H2O]ЪЧЗжЮіЛЏбЇГЃгУЕФЛљзМЪдМСЃЌЙЄвЕЩЯГЃгУТСЭСПѓ(жївЊГЩЗжЮЊAl2O3)РДЩњВњяЇУїЗЏЃЌЦфжаZЕФЫЎШмвКПЩгУгкЩЫПкЯћЖОЃЌЦфЙЄвеСїГЬЭМШчЯТЃК
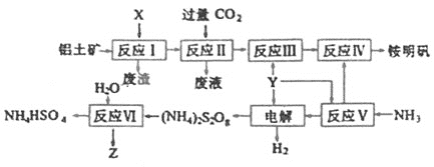
ЃЈ1ЃЉаДГіЗДгІЂђЕФРызгЗНГЬЪН________ЁЃ
ЃЈ2ЃЉДгЗДгІIVЕФяЇУїЗЏШмвКжаЛёЕУяЇУїЗЏОЇЬхЕФЪЕбщВйзївРДЮЮЊ________ЁЂ________ЁЂЙ§ТЫЁЂЯДЕг(ЬюВйзїУћГЦ)ЁЃ
ЃЈ3ЃЉЗДгІЂіЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ЃЈ4ЃЉЗЯЫЎжаКЌгаFe2+ЁЂMn2+ЕШН№ЪєРызгЖдздШЛЛЗОГгабЯжиЕФЦЦЛЕзїгУЃЌПЩгУ(NH4)2S2O8бѕЛЏГ§ШЅЁЃаДГіMn2+БЛбѕЛЏЩњГЩMnO2ЕФРызгЗНГЬЪНЮЊ________ЁЃZвВгаНЯЧПбѕЛЏадЃЌдкЪЕМЪЩњВњжаВЛгУZбѕЛЏMn2+ЕФдвђЪЧ________ЁЃ
ЁОД№АИЁПAlO2-+CO2+2H2O=Al(OH)3Ё§+HCO3- еєЗЂХЈЫѕ РфШДНсОЇ (NH4)2S2O8+2H2O=2NH4HSO4+H2O2 S2O82-+2H2O+Mn2+=4H++2SO42-+MnO2Ё§ УЬЕФЛЏКЯЮяПЩДпЛЏH2O2ЕФЗжНтЃЌЪЙЯћКФЕФH2O2діЖр
ЁОНтЮіЁП
ЃЈ1ЃЉЗДгІЂёЪдМСXЮЊМюШмвКЃЌТСЭСПѓжаЕФAl2O3ЗДгІаЮГЩAlO2ЃЃЌвђДЫЗДгІЂђжаЭЈШыЙ§СПЕФCO2ЃЌЗДгІЩњГЩAl(OH)3ГСЕэКЭHCO3ЃЃЛ
ЃЈ2ЃЉДгяЇУїЗЏШмвКжаЛёЕУяЇУїЗЏОЇЬхЕФВйзїЮЊеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЃЛ
ЃЈ3ЃЉЗДгІЂіжаЗДгІЮяЮЊ(NH4)2S2O8КЭH2OЃЌЩњГЩЮяЮЊNH4HSO4КЭH2O2ЃЛ
ЃЈ4ЃЉИљОнЛЏКЯМлЩ§НЕЗЈХфЦНЃЛMnO2ФмДпЛЏH2O2ЕФЗжНтЁЃ
ЃЈ1ЃЉЗДгІЂёЫљМгЪдМСXЮЊМюШмвКЃЌТСЭСПѓжаЕФAl2O3ЗДгІаЮГЩAlO2ЃЃЌвђДЫЗДгІЂђжаЭЈШыЙ§СПЕФCO2ЃЌЗДгІЩњГЩAl(OH)3ГСЕэКЭHCO3ЃЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊЃКAlO2ЃЃЋCO2ЃЋ2H2O=Al(OH)3Ё§ЃЋHCO3ЃЃЛ
ЃЈ2ЃЉДгяЇУїЗЏШмвКжаЛёЕУяЇУїЗЏОЇЬхЕФВйзїЮЊеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЃЛ
ЃЈ3ЃЉгЩЭМЪОСїГЬПЩжЊЃЌЗДгІЂіжаЗДгІЮяЮЊ(NH4)2S2O8КЭH2OЃЌЩњГЩЮяЮЊNH4HSO4КЭZЃЌгЩгкZОпгабѕЛЏадЃЌЭЌЪБНсКЯбѕЛЏЛЙдЙцТЩПЩЕУЃЌZЮЊH2O2ЃЌвђДЫИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК(NH4)2S2O8+2H2O=2NH4HSO4+H2O2ЃЛ
ЃЈ4ЃЉMn2ЃЋБЛбѕЛЏЩњГЩMnO2ЕФЙ§ГЬжаЃЌS2O82ЃБЛЛЙдЮЊSO42ЃЃЛЙ§ГЬжаУЬдЊЫигЩЃЋ2МлБфЮЊЃЋ4МлЃЌЪЇШЅ2ИіЕчзгЃЌСђдЊЫигЩЃЋ7МлБфЮЊЃЋ6МлЃЌЕУЕНСНИіЕчзгЃЌИљОнЕУЪЇЕчзгЪиКуПЩЕУЃЌMn2ЃЋКЭMnO2ЁЂS2O82ЃЕФЯЕЪ§ЖМЮЊ1ЃЌSO42ЃЕФЯЕЪ§ЮЊ2ЃЛИљОнЕчКЩЪиКуПЩЕУЃЌЩњГЩЮяжаКЌгаHЃЋЃЌЧвЯЕЪ§ЮЊ4ЃЛИљОнЧтдзгИіЪ§ЪиКуПЩЕУЃЌЗДгІЮяжагаH2OЃЌЧвЦфЯЕЪ§ЮЊ2ЃЛвђДЫПЩЕУИУЗДгІЕФРызгЗНГЬЪНЮЊЃКS2O82-+2H2O+Mn2+=4H++2SO42-+MnO2Ё§ЃЛ
гЩЩЯЪіЗжЮіПЩжЊЃЌZЮЊH2O2ЃЌ MnO2ФмДпЛЏH2O2ЕФЗжНтЃЌвђДЫВЛгУZбѕЛЏMn2ЃЋЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЙ§ГЬжаВЛДцдкЕчзгзЊвЦЕФЪЧЃЈ ЃЉ
A.ZnЃЋ2HCl=ZnCl2ЃЋH2Ёќ
B.Ca(ClO)2ЃЋ2HCl=CaCl2ЃЋ2HClO
C.Pb3O4ЃЋ8HCl(ХЈ)=3PbCl2ЃЋCl2ЁќЃЋ4H2O
D.3Cl2ЃЋ6KOH(ХЈ)![]() 5KClЃЋKClO3ЃЋ3H2O
5KClЃЋKClO3ЃЋ3H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКубЙЁЂNOКЭO2ЕФЦ№ЪМХЈЖШвЛЖЈЕФЬѕМўЯТЃЌДпЛЏЗДгІЯрЭЌЪБМфЃЌВтЕУВЛЭЌЮТЖШЯТNOзЊЛЏЮЊNO2ЕФзЊЛЏТЪШчЭМжаЪЕЯпЫљЪО(ЭМжаащЯпБэЪОЯрЭЌЬѕМўЯТNOЕФЦНКтзЊЛЏТЪЫцЮТЖШЕФБфЛЏ)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
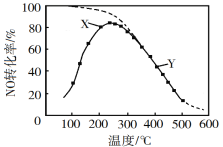
A.ЗДгІ2NO(g)+O2(g)![]() 2NO2(g)ЕФІЄH>0
2NO2(g)ЕФІЄH>0
B.ЭМжаXЕуЫљЪОЬѕМўЯТЃЌбгГЄЗДгІЪБМфВЛФмЬсИпNOзЊЛЏТЪ
C.ЭМжаYЕуЫљЪОЬѕМўЯТЃЌдіМгO2ЕФХЈЖШВЛФмЬсИпNOзЊЛЏТЪ
D.380ЁцЯТЃЌcЦ№ЪМ(O2)=5.0ЁС104 molЁЄL1ЃЌNOЦНКтзЊЛЏТЪЮЊ50%ЃЌдђЦНКтГЃЪ§K>2000
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОлЬМЫсѕЅ( )ЕФЭИЙтТЪСМКУЁЃЫќПЩжЦзїГЕЁЂДЌЁЂЗЩЛњЕФЕВЗчВЃСЇЃЌвдМАблОЕЦЌЁЂЙтХЬЁЂГЊЦЌЕШЁЃЫќПЩгУТЬЩЋЛЏбЇдСЯX(
)ЕФЭИЙтТЪСМКУЁЃЫќПЩжЦзїГЕЁЂДЌЁЂЗЩЛњЕФЕВЗчВЃСЇЃЌвдМАблОЕЦЌЁЂЙтХЬЁЂГЊЦЌЕШЁЃЫќПЩгУТЬЩЋЛЏбЇдСЯX(![]() )гыСэвЛдСЯYЗДгІжЦЕУЃЌЭЌЪБЩњГЩМзДМЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
)гыСэвЛдСЯYЗДгІжЦЕУЃЌЭЌЪБЩњГЩМзДМЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. YЕФЗжзгНсЙЙжага2ИіЗгєЧЛљ B. YЕФЗжзгЪНЮЊC15H18O2
C. XЕФКЫДХЙВеёЧтЦзга1ИіЮќЪеЗх D. XЁЂYЩњГЩОлЬМЫсѕЅЗЂЩњЕФЪЧЫѕОлЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТСМАЦфЛЏКЯЮядкЩњВњЁЂЩњЛюЕШЗНУцгаЙуЗКЕФгІгУЁЃ
ЃЈ1ЃЉТСдЊЫиЮЛгкжмЦкБэжаЕк________жмЦк________зхЁЃХ№ЁЂяигыТСЮЛгкЭЌвЛжїзхЃЌЯжгаЯТСаШ§жжЮяжЪЃКЂйNaAlO2ЁЂЂкNaBO2ЁЂЂлNaGaO2ЃЌХЈЖШЯрЭЌЕФетШ§жжЮяжЪЕФШмвКpHгЩДѓЕНаЁЕФЫГађЮЊ________(гУађКХБэЪО)ЁЃ
ЃЈ2ЃЉНЋ20.0 mL 0.1 molЁЄLЃ1 Ba(OH)2ШмвККЭ20.0 mL 0.1 molЁЄLЃ1 NH4Al(SO4)2ШмвКЛьКЯЃЌЫљЕУШмвКжаAl3ЃЋЁЂNH![]() ЁЂSO
ЁЂSO![]() ЁЂOHЃЁЂHЃЋЕФХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ________________________ЁЃ
ЁЂOHЃЁЂHЃЋЕФХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ________________________ЁЃ
ЃЈ3ЃЉЕЊЛЏТС(AlN)ЪЧвЛжжаТаЭЕФЮоЛњЗЧН№ЪєВФСЯЃЌПЩгУзїШШНЛЛЛЦїВФСЯЁЃФГAlNбљЦЗжаНіКЌгаAl2O3дгжЪЃЌЮЊВтЖЈAlNЕФКЌСПЃЌМззщЭЌбЇЩшМЦСЫШчЯТСїГЬЃК

вбжЊЃКAlNЃЋNaOHЃЋH2O=NaAlO2ЃЋNH3ЁќЁЃ
ЂйЙ§ТЫЪБгУЕНЕФВЃСЇвЧЦїгаЩеБЁЂТЉЖЗКЭ________ЁЃ
ЂкЪЕбщЙ§ГЬжаЃЌГЦЕУбљЦЗЕФжЪСПЮЊ4.2 gЃЌзюКѓЕУЕНЕФЙЬЬхЮЊ5.1 gЃЌдђбљЦЗжаAlNЕФжЪСПЗжЪ§ЮЊ________ЁЃ(ВЛПМТЧећИіЙ§ГЬжаЕФЫ№КФ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаВйзїЛсЪЙХфжЦШмвКЕФЮяжЪЕФСПХЈЖШЦЋИпЕФЪЧ
A.УЛгаЯДЕгЩеБКЭВЃСЇАє
B.ЖЈШнЪБАМвКУцзюЕЭДІЕЭгкПЬЖШЯп
C.ШнСПЦПгУеєСѓЫЎЯДЕгИЩОЛКѓУЛгаИЩдяОЭвЦШыЫљХфжЦШмвК
D.зЊвЦЙ§ГЬжагаЩйСПШмвКНІГі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУдЊЫиЕФЛЏКЯМлЭЦВтЮяжЪЕФаджЪЪЧЛЏбЇбаОПЕФживЊЪжЖЮЁЃШчЭМЪЧСђдЊЫиЕФГЃМћЛЏКЯМлгыВПЗжЮяжЪРрБ№ЕФЖдгІЙиЯЕЃК
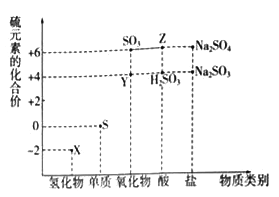
ЃЈ1ЃЉДгСђдЊЫиЛЏКЯМлБфЛЏЕФНЧЖШЗжЮіЃЌЭМжаМШгабѕЛЏадгжгаЛЙдадЕФЛЏКЯЮяга_______ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ2ЃЉНЋXгыYЛьКЯЃЌПЩЩњГЩЕЛЦЩЋЙЬЬхЃЌИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ_______ЁЃ
ЃЈ3ЃЉZЕФХЈШмвКгыЭЕЅжЪдквЛЖЈЬѕМўЯТПЩвдЗЂЩњЛЏбЇЗДгІЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЁЃ
ЃЈ4ЃЉNa2S2O3ЪЧживЊЕФЛЏЙЄдСЯЃЎДгбѕЛЏЛЙдЗДгІЕФНЧЖШЗжЮіЃЌЯТСажЦБИNa2S2O3ЕФЗНАИРэТлЩЯПЩааЕФЪЧ______ЃЈЬюДњКХЃЉЁЃ
aЃЎNa2S+S bЃЎNa2SO3+S cЃЎSO2+Na2SO4 dЃЎNa2SO3+Na2SO4
ЃЈ5ЃЉвбжЊNa2SO3ФмБЛK2Cr2O7бѕЛЏЮЊNa2SO4дђ24mL 0.05molLЉ1ЕФNa2SO3ШмвКгы 20mL 0.02molLЉ1ЕФK2Cr2O7ШмвКЧЁКУЗДгІЪБЃЌCrдЊЫидкЛЙдВњЮяжаЕФЛЏКЯМлЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧФГЭЌбЇЬНОПNa2SO3ШмвККЭИѕ(VI)бЮШмвКЗДгІЙцТЩЕФЪЕбщМЧТМЃЌвбжЊЃКCr2O72-(ГШЩЋ)+ H2O![]() 2CrO42-(ЛЦЩЋ)+ 2H+
2CrO42-(ЛЦЩЋ)+ 2H+
ађКХ | a | b | ЯжЯѓ | |
| 1 | 2 mL 0.05 molЁЄL1 K2Cr2O7ШмвК(pH = 2) | 3ЕЮБЅКЭNa2SO3ШмвК(pH = 9) | ШмвКБфТЬЩЋ(КЌCr3+) |
2 | 2 mL 0.1 molЁЄL1 K2CrO4ШмвК(pH = 8) | 3ЕЮБЅКЭNa2SO3ШмвК | ШмвКУЛгаУїЯдБфЛЏ | |
3 | 2 mLБЅКЭNa2SO3ШмвК | 3ЕЮ0.05 molЁЄL1 K2Cr2O7ШмвК | ШмвКБфЛЦЩЋ | |
4 | 2 mLеєСѓЫЎ | 3ЕЮ0.05 molЁЄL1 K2Cr2O7ШмвК | ШмвКБфГЩЧГГШЩЋ |
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЪЕбщ1жаЕФТЬЩЋШмвКжаКЌгаSO42-
B. ЪЕбщ1ЁЂ2ЕФaШмвКжаЫљКЌЕФРызгжжРрЯрЭЌ
C. ЯђЪЕбщ3ШмвКжаМЬајЕЮМгЙ§СПСђЫсПЩЪЙШмвКБфЮЊЧГГШЩЋ
D. ЪЕбщ4ЕФФПЕФЪЧХХГ§ЯЁЪЭЖдШмвКбеЩЋБфЛЏдьГЩЕФгАЯь
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСажИЖЈЗДгІЕФЗНГЬЪНе§ШЗЕФЪЧ
A.ЕчНтТШЛЏУОШмвКЃК2ClЈC+2H2O![]() H2Ёќ+Cl2Ёќ+2OHЈC
H2Ёќ+Cl2Ёќ+2OHЈC
B.ЬМЫсЧтяЇШмвКжаМгШызуСПЪЏЛвЫЎЃКCa2++![]() +OHЈC=CaCO3Ё§+H2O
+OHЈC=CaCO3Ё§+H2O
C.Al2(SO4)3ШмвКжаМгШыЙ§СПАБЫЎЃКAl3++3NH3ЁЄH2O=Al(OH)3Ё§+3NH4+
D.ЧтбѕЛЏБЕШмвКжаМгШыЯЁСђЫсЃКHЃЋ(aq)ЃЋOHЃ(aq)=H2O(l)ЁЁІЄHЃНЃ57.3 kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com