
【题目】下列解释事实的离子方程式不正确的是( )
A.用石墨电极电解饱和食盐水:2Cl- + 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+CO32-![]() CaCO3(s) + SO42-
CaCO3(s) + SO42-
C.过量铁粉与稀硝酸反应:Fe+NO3-+4H+= Fe3++NO↑+2H2O
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
【答案】C
【解析】
A. 用石墨电极电解饱和食盐水生成氢氧化钠、氢气和氯气,离子反应为:2Cl- +2H2O![]() 2OH-+ H2↑+ Cl2↑,故A正确;
2OH-+ H2↑+ Cl2↑,故A正确;
B. 用Na2CO3溶液处理水垢中的CaSO4,利用沉淀溶解平衡,沉淀向更难溶的方向进行,反应的离子方程式为CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),故B正确;
CaCO3(s)+SO42-(aq),故B正确;
C. 过量铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,离子反应为:3Fe+8H++2NO3-═Fe2++2NO↑+4H2O,故C错误;
D. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全生成硫酸钡、氢氧化钠和水,离子反应为:Ba2++OH-+H++SO42-= BaSO4↓+H2O,故D正确;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2Mg+CO2![]() 2MgO+C,某同学推测钠与CO2也能反应,为探究反应产物,利用下图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd,饱和NaHCO3溶液可以用于除去CO2 中的HC1气体)
2MgO+C,某同学推测钠与CO2也能反应,为探究反应产物,利用下图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd,饱和NaHCO3溶液可以用于除去CO2 中的HC1气体)
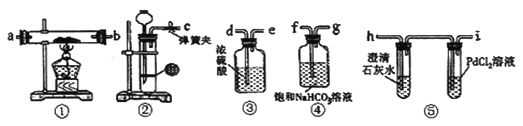
(1)装置②中用稀盐酸与CaCO3反应制备CO2,制备该气体时发生反应的离子方程式是_______。
(2)请将图中各装置按顺序连接(填裝置接口字母): c接___,__接___,___接____,__接____。
(3)装置③的作用是_______。
(4)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到________时再点燃酒精灯。此步操作的目的是_______。
(5)根据下列实验现象,推测并请写出钠与CO2反应的化学方程式。
I.实验过程中若观察到装置⑤PdCl2溶液中有黑色沉淀,且装置①中固体成分(正盐)只有一种,向该固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体。请写出钠与CO2反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.溶液中 SO42-向负极移动
C.铜为阳极,锌为阴极
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.0.1mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强
B.适当升高温度,CH3COOH溶液pH增大
C.稀释0.1 mol/L NaOH溶液,水的电离程度减小
D.CH3COONa溶液中加入少量CH3COOH,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
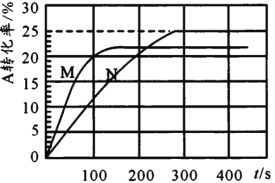
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
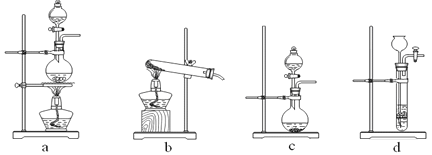
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。
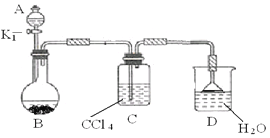
①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
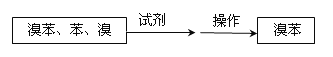
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃,每100g水仅能溶解0.148gCa(OH)2。CaCO3在水中达到溶解平衡时,其Ksp为8.0×10-9(溶液密度近似为1g/cm3)。
(1)计算20℃时Ca(OH)2饱和溶液中的c(OH-);_________
(2)在10 mL Ca(OH)2饱和溶液中加入10mL0.10mol/L的K2CO3溶液,忽略溶液体积变化,通过计算判断是否生成CaCO3沉淀_________,并求此时溶液中c(Ca2+)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com