
【题目】用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
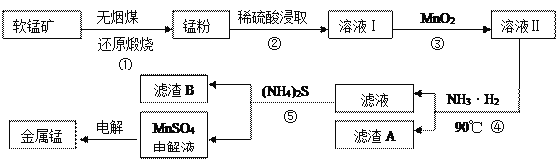
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
【答案】 2MnO2+C![]() 2MnO+CO2↑(或MnO2+C
2MnO+CO2↑(或MnO2+C![]() MnO+CO↑) MnO2>Cl2>Fe3+ 2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O 6 MnSO4 CuS、HgS MnO42-- e-=== MnO4-
MnO+CO↑) MnO2>Cl2>Fe3+ 2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O 6 MnSO4 CuS、HgS MnO42-- e-=== MnO4-
【解析】试题分析:(1)碳具有还原性将MnO2还原为MnO;(2)氧化剂的氧化性大于氧化产物,结合实验室制备氯气和氯气氧化Fe2+分析;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+;(4)根据Fe(OH)3的Ksp=6.4×10-25计算Fe3+完全沉淀时c(OH-),再根据水的离子积醋酸计算c(H+);(5)反应②是MnO与硫酸生成MnSO4和水;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾。
解析:(1)碳具有还原性将MnO2还原为MnO,反应方程式是2MnO2+C![]() 2MnO+CO2↑;(2)氧化剂的氧化性大于氧化产物,实验室可用软锰矿与浓盐酸反应制Cl2说明氧化性MnO2>Cl2;氯气能把Fe2+氧化为Fe3+说明氧化性Cl2>Fe3+,所以氧化性MnO2>Cl2>Fe3+;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O;(4)Ksp=6.4×10-25计算Fe3+完全沉淀时的浓度是
2MnO+CO2↑;(2)氧化剂的氧化性大于氧化产物,实验室可用软锰矿与浓盐酸反应制Cl2说明氧化性MnO2>Cl2;氯气能把Fe2+氧化为Fe3+说明氧化性Cl2>Fe3+,所以氧化性MnO2>Cl2>Fe3+;(3)MnO2的氧化性大于Fe3+,溶液I中加入一定质量的MnO2测定Fe2+的浓度, MnO2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++ MnO2+4H+===2Fe3++ Mn2++2H2O;(4)Ksp=6.4×10-25计算Fe3+完全沉淀时的浓度是![]() ,c(OH-)=
,c(OH-)=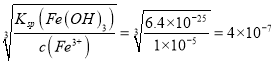 , c(H+)=
, c(H+)=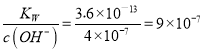 ,PH=
,PH=![]() =6;(5)反应②是MnO与硫酸生成MnSO4和水,所以溶液Ⅰ的主要成分为MnSO4;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+,所以滤渣B的主要成分为CuS、HgS;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾,阳极电极反应是MnO42-- e-=== MnO4-。
=6;(5)反应②是MnO与硫酸生成MnSO4和水,所以溶液Ⅰ的主要成分为MnSO4;反应⑤加入(NH4)2S是除去溶液中的重金属离子Cu2+、Hg2+,所以滤渣B的主要成分为CuS、HgS;(6)阳极发生氧化反应,锰酸钾生成高锰酸钾发生氧化反应,所以阳极反应是锰酸钾生成高锰酸钾,阳极电极反应是MnO42-- e-=== MnO4-。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系: ![]()
(1)若该反应是非氧化还原反应 ①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为
②X是一种盐,焰色反应为黄色,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,Y的化学式为 .
③若W为一种强碱,Y具有两性,则向Z溶液中通入少量二氧化碳的离子方程式为 .
(2)若该反应是氧化还原反应 ①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 .
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 , X转化为Y的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从 KNO3和少量 NaCl 杂质的混合物中提纯 KNO3.涉及的操作依次有:①溶解 ②过滤 ③结晶 ④冷却 ⑤蒸发浓缩.其中合理的是( )
A. ①②③④⑤ B. ①⑤④③② C. ①③⑤④② D. ①②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度 .
(2)c(Na+)+c(H+)═ .
(3)c(Na+)═ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法中,正确的是( )
A.海水淡化﹣﹣﹣﹣﹣﹣蒸馏
B.将碘单质从沙子提取出来﹣﹣﹣﹣﹣﹣﹣﹣过滤
C.盐水中获得食盐﹣﹣﹣﹣﹣﹣﹣﹣萃取分液
D.稀释浓硫酸时将水慢慢加入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素及其化合物在科学研究和生产生活中有着广泛的用途
(1)氢气还原氧化铜时,产生的红色物质,冷却后加入稀硫酸发现溶液呈淡蓝色,写出该现象发生的离子方程式__________________________。
(2)取铝合金(含铝90%)1.5 g 与适量的 盐酸恰好完全反应(合金中其它成分不参加反应)。滤去不溶物,向滤液加入0.6 molL-1 的氨水使Al3+ 恰好完全沉淀。上述铝合金和盐酸反应的过程中生成氢气_____L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是合成其它铬盐的重要原料,在无机合成和有机合成中有重要的作用,是合成饲料添加剂的主要成份,工业上主要用作媒染剂及催化剂.易溶于水,溶于乙醇,几乎不溶于乙醚,易潮解,易升华.在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)且2CrO42﹣+2H+Cr2O72﹣+H2O.制三氯化铬的流程如下: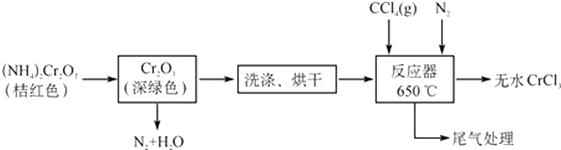
(1)三氯化铬碱性条件下被H2O2氧化为Cr(Ⅵ)的离子反应方程式为 .
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 .
(3)用如图装置制备CrCl3时,主要步骤包括: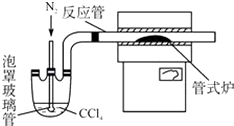
①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;③三颈烧瓶中装入150mLCCl4 , 并加热CCl4 , 温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4 , 继续通入氮气;⑥检查装置气密性.
正确的操作顺序为:⑥→③→ , 步骤②中通如氮气的作用 .
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2 , 因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2 , 生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式 .
(5)样品中三氯化铬质量分数的测定称取样品0.3300g,加水溶解并定容于250mL容量瓶中.移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2 , 充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.已知:Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2═Na2S4O6+2NaI.
①指示剂为 , 滴定终点的现象为 .
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 .
③样品中无水三氯化铬的质量分数为 . (计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: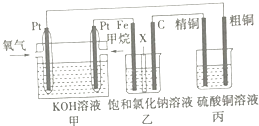
(1)甲烷燃料电池正极反应式是 .
(2)乙装置中阳离子通过X膜向极(填“Fe”或“C”)移动,石墨(C)极的电极反应式为 .
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为g,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com