
����Ŀ�����Ȼ����Ǻϳ��������ε���Ҫԭ�ϣ������ϳɺ��л��ϳ�������Ҫ�����ã��Ǻϳ��������Ӽ�����Ҫ�ɷݣ���ҵ����Ҫ����ýȾ����������������ˮ�������Ҵ����������������ѣ��׳��⣬���������ڸ������ܱ����������������������ܱ�H2O2����ΪCr��������2CrO42��+2H+Cr2O72��+H2O�������Ȼ������������£�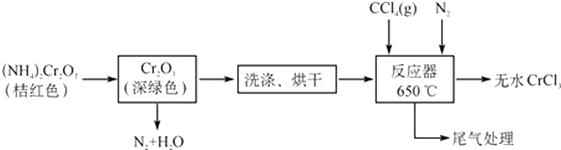
��1�����Ȼ������������±�H2O2����ΪCr�����������ӷ�Ӧ����ʽΪ ��
��2����֪CCl4�е�Ϊ57.6�棬Ϊ��֤�ȶ���CCl4���������˵ļ��ȷ�ʽ�� ��
��3������ͼװ���Ʊ�CrCl3ʱ����Ҫ���������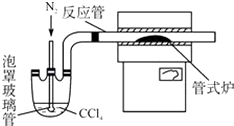
�ٽ������ռ����������У��ڼ��ȷ�Ӧ����400�棬��ʼ��������ƿ��ͨ�뵪�����������µ�650�棻��������ƿ��װ��150mLCCl4 �� ������CCl4 �� �¶ȿ�����50��60��֮�䣻�ܷ�Ӧ�ܳ��ڶ˳�����CrCl3������ʱ���жϼ��ȹ�ʽ¯�ĵ�Դ����ֹͣ����CCl4 �� ����ͨ�뵪�������װ�������ԣ�
��ȷ�IJ���˳��Ϊ���ޡ��ۡ� �� �������ͨ�絪�������� ��
��4����֪��Ӧ���з�������Ҫ��Ӧ�У�Cr2O3+3CCl4��2CrCl3+3COCl2 �� ������綾��ʵ������ͨ����н��У������Ҵ�����COCl2 �� ����һ�ֺ���������C5H10O3�������Ҵ�����β���Ļ�ѧ����ʽ ��
��5����Ʒ�����Ȼ������������IJⶨ��ȡ��Ʒ0.3300g����ˮ�ܽⲢ������250mL����ƿ�У���ȡ25.00mL�ڵ���ƿ��һ�ִ�������ƿ���У��������к����1gNa2O2 �� ��ּ�����У��ʵ�ϡ�ͣ�Ȼ����������2mol/LH2SO4����Һ��ǿ���ԣ���ʱ����Cr2O72�����ڣ��ټ���1.1gKI��������ҡ�ȣ��ڰ�������5���Ӻ���1mLָʾ������0.0250mol/L�����������Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı������������Һ24.00mL����֪��Cr2O72��+6I��+14H+=2Cr3++3I2+7H2O��2Na2S2O3+I2�TNa2S4O6+2NaI��
��ָʾ��Ϊ �� �ζ��յ������Ϊ ��
���������ƿ��CrCl3��Һ�������У�����Na2O2��ҲҪ������У�����Ҫԭ���� ��
����Ʒ����ˮ���Ȼ�������������Ϊ �� ����������ȷ��0.1%��
���𰸡�
��1��2Cr3++3H2O2+10OH��=2CrO ![]() +8H2O
+8H2O
��2��ˮԡ���ȣ������¶ȼ�ָʾ�¶ȣ�
��3���ڡ��ܡ��ݡ���CCl4���������뷴Ӧװ���У����߿�������ֹCrCl3������
��4��COCl2+2C2H5OH��C2H5OCOC2H5+2HCl
��5�����ۣ����һ�ε���ʱ����ɫǡ����ȫ��ȥ���Ұ�����ڲ��ָ�ԭɫ����ȥ�����ܽ����������ֹ������I������������ƫ�ߵ���96.1%
���������⣺��1�����Ȼ������������±�H2O2����Ϊ����������ݵ���غ��Ԫ���غ��֪���ӷ���ʽΪ2Cr3++3H2O2+10OH��=2CrO42��+8H2O�����Դ��ǣ�2Cr3++3H2O2+10OH��=2CrO42��+8H2O����2����ΪCCl4�е�Ϊ76.8�棬�¶ȱȽϵͣ���˱�֤�ȶ���CCl4����������ͨ��ˮԡ�����������������������¶ȼ�ָʾ�¶ȣ����Դ��ǣ�ˮԡ���ȣ������¶ȼ�ָʾ�¶ȣ�����3���ɣ�4����֪��Ӧ�Ʊ�ԭ��ΪCr2O3+3CCl4��2CrCl3+3COCl2 �� ���Ȼ�̼�ڹ�ʽ¯�з�Ӧ����Cr2O3��Ӧ����Ӧ�ܳ��ڶ˳�����CrCl3������ʱ���жϼ��ȹ�ʽ¯�ĵ�Դ��ֹͣ����CCl4 �� ����ͨ�뵪�����������ռ��������ʲ���˳��Ϊ���ޡ��ۡ��ڡ��ܡ��ݡ��٣��������ͨ�뵪�������Խ�CCl4�������뷴Ӧװ���У����߿�������ֹCrCl3�����������Դ��ǣ��ڡ��ܡ��ݡ��٣���CCl4�������뷴Ӧװ���У����߿�������ֹCrCl3����������4���ɷ���ʽ��֪��COCl2�е�2��Clԭ�ӱ�2����OC2H5���棬���Ҵ���COCl2����ȡ����Ӧ����OC2H5ȡ����ԭ������C2H5OCOC2H5��HCl����Ӧ����ʽΪCOCl2+2C2H5OH��C2H5OCOC2H5+2HCl�����Դ��ǣ�COCl2+2C2H5OH��C2H5OCOC2H5+2HCl����5��������Na2S2O3�ζ�����I2 �� I2����������ɫ�����Կ����õ�����ָʾ�����������һ��ʱ�������Һ��ɫ�ڰ�����ڲ���ɫ����ﵽ�ζ��յ㣬���Դ��ǣ����ۣ����һ�ε���ʱ����ɫǡ����ȫ��ȥ���Ұ�����ڲ��ָ�ԭɫ������Һ�����ܽ��������������������I��������������ȥ�����ܽ������ʹ���ɵ�I2����������ƫ�ߵ����ʼ�����У�����Ҫԭ���ǣ���ȥ�����ܽ����������ֹ������I������������ƫ�ߵ������Դ��ǣ���ȥ�����ܽ����������ֹ������I������������ƫ�ߵ�������25.00mL��Һ��n��Cr3+������CrԪ���غ㼰����ʽ�ɵù�ϵʽ2Cr3++��Cr2O72����3I2��6Na2S2O3 �� ���ݹ�ϵʽ���㣬
2Cr3++��Cr2O72����3I2��6Na2S2O3 ��
2 6
n��Cr3+�� 0.0250mol/L��0.024L
��n��Cr3+��=0.0250mol/L��0.024L�� ![]() ������250mL��Һ��n�䣨Cr3+��=0.0250mol/L��0.024L��
������250mL��Һ��n�䣨Cr3+��=0.0250mol/L��0.024L�� ![]() ��
�� ![]() =0.002mol������CrԪ���غ��֪n��CrCl3��=n�䣨Cr3+��=0.002mol��������Ʒ��m��CrCl3��=0.002mol��158.5g/mol=0.317g������Ʒ����ˮ���Ȼ�������������Ϊ
=0.002mol������CrԪ���غ��֪n��CrCl3��=n�䣨Cr3+��=0.002mol��������Ʒ��m��CrCl3��=0.002mol��158.5g/mol=0.317g������Ʒ����ˮ���Ȼ�������������Ϊ ![]() ��100%=96.1%��
��100%=96.1%��
���Դ��ǣ�96.1%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaCl��Na2CO3��10H2O��NaHCO3�Ļ���ijͬѧ�������ʵ�飬ͨ��������Ӧǰ��C��Dװ�������ı仯���ⶨ�û�����и���ֵ�����������
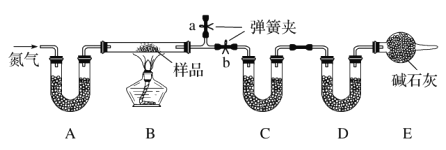
(1)����ǰͨ�뵪����Ŀ����__________����������Ϊ_______________��
(2)װ��A��C��D��ʢ�ŵ��Լ��ֱ�ΪA_____��C_____��D_____��
(3)����Aװ�û���ʢ��NaOH��Һ��ϴ��ƿ�����õ�NaCl�ĺ�����_____���ƫ�ߡ�����ƫ�͡�����Ӱ�족����ͬ������B�з�Ӧ���Ҳ���ˮ������������ⶨ�����NaHCO3�ĺ�����_____������ȥEװ�ã�����Na2CO3��10H2O�ĺ�����_____��
(4)����Ʒ����Ϊwg����Ӧ��C��D���ӵ������ֱ�Ϊm1g��m2g���ɴ˿�֪�������NaHCO3����������Ϊ_______���ú�w��m1��m2�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���Ҫ�ɷ�ΪMnO2����������������ͭ�����Ļ�����Ʊ�MnSO4���Һ�̶���ȡ�̵Ĺ�ҵ��������
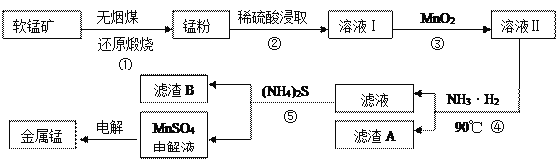
��1����֪�̷۵���Ҫ�ɷ�ΪMnO����Ӧ�ٵĻ�ѧ����ʽΪ________________________��
��2��ʵ���ҿ������̿���Ũ���ᷴӦ��Cl2���Ƚ�MnO2��C12��Fe3+��������ǿ����_______��
��3����ҺI�м���һ��������MnO2�ԲⶨFe2+��Ũ�ȣ�����MnO2�йط�Ӧ�����ӷ���ʽΪ___________________________________________________________________��
��4����֪90��ʱˮ�����ӻ�����Kw=3��6��10��13��Fe(OH)3��Ksp=6��4��10��25��Ҫʹ����A������ȫ�����ð�ˮ��pH����Ϊ______����֪lg 3��0��5����
��5����Һ������Ҫ�ɷ�Ϊ ____________������B����Ҫ�ɷ�Ϊ_________________��
��6����ҵ���ö��������Ʊ�������أ����ö��������Ƶ�����أ����ö��Ե缫����������Һ�õ�������أ����ʱ������ӦʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʒ�Ӧѡ�õ������ǣ� ��
A.�մ�����B.ʯӢ����
C.��ͨ��������D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�Ƶ�ؾ������С����������洢װ�õ��ŵ㡣һ��������N2H4��Ϊȼ�ϵĵ��װ������ͼװ�������õ���ÿ����е�������Ϊ��������KOH��Ϊ����ʡ������й���������ȷ����
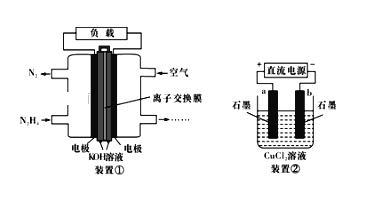
A. ��ȼ�ϵ�ظ��������ĵ缫��ӦΪ��N2H4+4OH--4e-�TN2��+4H2O
B. �ø�ȼ�ϵ����Ϊװ������ֱ����Դ������7.1gCl2���������0.5molN2H4
C. ��ȼ�ϵ�طŵ�һ��ʱ���KOH��Һ��pH���ֲ��䣨KOH��Һ����ֽ����Һ��Է�Ӧ��������Һ����ĸı䣩
D. ��ȼ�ϵ�صĵ缫����Ӧ���ö������ϣ���Ŀ������ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ʷ�����ѧ��Ӧʱ�������������仯
B.���ȷ�Ӧһ��Ҫ�ڼ��Ȼ���������²��ܽ���
C.Ũ��������ˮʱ���۽����Ѳ��ų��������ȣ����Ըù����Ƿ��ȷ�Ӧ
D.��ɫ��Ӧ�������仯��������ɫ��Ӧ�ǻ�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�������ڱ��е�λ����ͼ,����ֻ��MΪ����Ԫ�ء�����˵������ȷ������ ��

A. Y������������Ӧˮ��������Ա�X����
B. ԭ�Ӱ뾶Z<M
C. X�������̬�⻯������ȶ��Ա�Z��С
D. Zλ��Ԫ�����ڱ��е�2���ڡ��ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.�����£�pH��7�Ĵ���ʹ����ƵĻ����Һ�У�c��CH3COO������c��Na+��
B.�������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ����Һ�У�c��Na+��=c��Cl����
C.��pH�İ�ˮ��KOH��Һ��Ba��OH��2��Һ�У�c��NH ![]() ��=c��K+��=c��Ba2+��
��=c��K+��=c��Ba2+��
D.0.2mol?L��1ijһԪ����HA��Һ��0.1mol?L��1NaOH��Һ�������Ϻ����Һ��2c��OH����+c��A����=2c��H+��+c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ʵ������֤����ˮ������������ǣ���ʵ��������в������̣���Щ�������̵���ȷ����˳���ǣ�������
��ȡ�������ۺ�ˮ�Ƴ���Һ���ڼ�����С��ۼ����Һ�к����ԡ��ܼ�������Cu(OH)2��������Һ���ݼ�������ϡ���ᡡ���ټ���
A.�٢ڢݢޢܢ�B.�٢ݢڢܢޢ�
C.�٢ݢڢۢܢ�D.�٢ޢܢݢۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com