
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: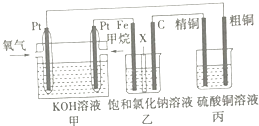
(1)甲烷燃料电池正极反应式是 .
(2)乙装置中阳离子通过X膜向极(填“Fe”或“C”)移动,石墨(C)极的电极反应式为 .
(3)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为g,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
【答案】
(1)O2+2H2O+4e﹣═4OH﹣
(2)Fe;2Cl﹣﹣2e﹣═Cl2↑
(3)12.8;减小
【解析】解:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,电极反应式为:O2+2H2O+4e﹣═4OH﹣;所以答案是:O2+2H2O+4e﹣═4OH﹣;(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳离子通过X膜向阴极移动,所以阳极石墨上氯离子放电生成氯气,电极反应式为:2Cl﹣﹣2e﹣═Cl2↑;所以答案是:Fe;2Cl﹣﹣2e﹣═Cl2↑;(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌失电子进入溶液,反应式为:Zn﹣2e﹣=Zn2+、Cu﹣2e﹣=Cu2+ , 阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小; 根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2﹣﹣﹣﹣2H2﹣﹣﹣﹣2Cu,设生成铜的质量是x.O2~2H2~2Cu
22.4L 128g
2.24L x
x=12.8g
所以答案是:12.8g;减小.


科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
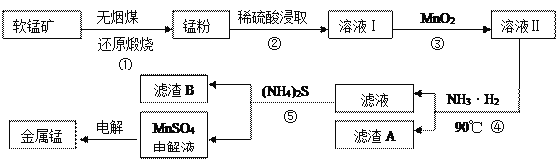
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. Y的最高价氧化物对应水化物的酸性比X的弱
B. 原子半径Z<M
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A.室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO﹣)>c(Na+)
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl﹣)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH ![]() )=c(K+)=c(Ba2+)
)=c(K+)=c(Ba2+)
D.0.2mol?L﹣1某一元弱酸HA溶液和0.1mol?L﹣1NaOH溶液等体积混合后的溶液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 ____。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 ____。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ____,微粒间存在的作用力是 ____。
(3)氧化物MO的电子总数与SiC的相等,则M为 ____(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ____。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2 的分子构型是 ________, SiO2的沸点 _______CO2的沸点(填“高于”或“低于”) ,理由是 _____________________。 CO2分子中σ键和π键的个数比为 ___________,其中心原子采取 _______杂化;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O
利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。

(1)E装置中制取NO2反应的化学方程式是________________________________。
(2)制取氨气时若只用一种试剂,从下列固体物质中选取___________
a.NH4HCO3 b.NH4C1 c.Ca(OH)2 d.NaOH
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是____________________。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
① NH3还原性较弱,不能将NO2还原;② 在此条件下,NO2的转化率极低;
③_______________________________________
(5)此实验装置存在一个明显的缺陷是________________________
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验。

① 装置的合理连接顺序是 _____________
② 实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验来验证淀粉水解可生成葡萄糖,其实验包括下列操作过程,这些操作过程的正确排列顺序是( )
①取少量淀粉和水制成溶液 ②加热煮沸 ③加入碱液中和酸性 ④加入新制Cu(OH)2碱性悬浊液 ⑤加入少量稀硫酸 ⑥再加热
A.①②⑤⑥④③B.①⑤②④⑥③
C.①⑤②③④⑥D.①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaNO3 (溶液)
B.CH3COONa(固体)
C.Na2CO3(溶液)
D.CuSO4 (固体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com