
����Ŀ������Ԫ�ؼ��仯�����ڿ�ѧ�о����������������Ź㷺����;
��1��������ԭ����ͭʱ�������ĺ�ɫ���ʣ���ȴ�����ϡ���ᷢ����Һ�ʵ���ɫ��д���������������ӷ���ʽ__________________________��
��2��ȡ���Ͻ𣨺���90����1.5 g �������� ����ǡ����ȫ��Ӧ���Ͻ��������ɷֲ��μӷ�Ӧ������ȥ���������Һ����0.6 molL-1 �İ�ˮʹAl3+ ǡ����ȫ�������������Ͻ�����ᷴӦ�Ĺ�������������_____L����״������ʹAl3+ ǡ����ȫ����ʱ�����İ�ˮ____mL��
���𰸡� Cu2O+2H+=Cu+Cu2++H2O 1.68L 250mL
�������������������1��������ԭ����ͭʱ��������ɫ���ʣ���һ��������ͭ��ԭΪ������ͭ��������ͭ�����ᷴӦ��������ͭ��ͭ��ˮ����2���������ᷴӦ�ķ���ʽ��![]() ���Ȼ����백ˮ��Ӧ�Ļ�ѧ����ʽ��
���Ȼ����백ˮ��Ӧ�Ļ�ѧ����ʽ��![]() �����ݷ���ʽ���㡣
�����ݷ���ʽ���㡣
��������1���������Ϸ�����������ԭ����ͭʱ��������ɫ���ʣ���һ��������ͭ��ԭΪ������ͭ��������ͭ�����ᷴӦ��������ͭ��ͭ��ˮ����Ӧ�����ӷ���ʽ��Cu2O+2H+=Cu+Cu2++H2O��
��2�������������������VL�������������������ʵ���xmol;
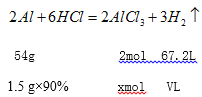
![]() �����V=1.68L��
�����V=1.68L�� ![]() ���x=0.05mol��
���x=0.05mol��
�����İ�ˮVL��
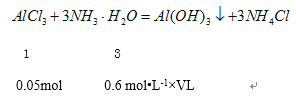
![]() �����V=0.25L=250mL��
�����V=0.25L=250mL��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ǰ�����ڵ�5��Ԫ�صIJ�����Ϣ���±���ʾ��
Ԫ�ش��� | Ԫ�ز�����Ϣ |
X | X�������Ӻ�������ƾ������� |
Y | ԭ�ӵ��ܼ�����3��δ�ɶԵ��ӣ��������̬�⻯����ˮ�е��ܽ����ͬ��Ԫ�����γɵ������̬�⻯������� |
Z | ��̬ԭ�ں�����3���ܼ�����˵��ӣ���������ܼ��ĵ���������ǰ�����ܼ��ĵ�����֮�� |
R | Ԫ��ԭ�ڵ�Χ�����Ų�ʽΪnsn-1npn-1 |
T | һ�ֺ��ص�������Ϊ65��������Ϊ36 |
��������Ԫ����Ϣ���ش���������:
��1����̬T2+�ĵ����Ų�ʽΪ____________��
��2��Y.Z.R �ĵ縺���ɴ�С��˳��Ϊ____________ (��Ԫ�ط��ű�ʾ)��
��3��YX4+�Ŀռ乹��Ϊ____________��������Yԭ�ӵ��ӻ��������Ϊ____________ ��YX4+����ʽΪ________��
��4��YX3��һ�ֵȵ����������______��YX3 �ļ��Ǵ���X2Z�ļ��ǵ���Ҫԭ����________��
��5��T���ʲ�����YX3��Һ��Ҳ������X2Z��Һ�������������ǵĻ����Һ������Ҫԭ�����γ����ȶ���[T(YX3)4]2+��1mol���������й�����______mol ������
��6��Z��T��ɵľ����ṹ����ͼ��ʾ����֪Z��Tԭ�ӵİ뾶�ֱ�Ϊapm��bpm�������߳�Ϊcpm����þ�����ԭ�ӵĿռ�������Ϊ________(�ô���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڡ�����˫��ˮ���ش��������⣺

��1���������������Լ�ƿ�����ʺ����ı�ǩ��_____________������ĸ����
��2�����з�Ӧ�У�H2O2���ֻ�ԭ�Ե���______________��
A��Na2O2��2HCl=2NaCl��H2O2
B��Ag2O��H2O2=2Ag��O2����H2O
C��3H2O2��Cr2(SO4)3��10KOH=2K2CrO4��3K2SO4��8H2O
D��K2Cr2O7��4H2O2��2H+ =2CrO5��5H2O[CrO5��Ϊ������������д��CrO(O2)2]
��3���ɿ��Һ�е��軯���KCN��һ����H2O2��������������ѧ����ʽΪ��KCN��H2O2��H2O=KHCO3��NH3����KCN��NΪ��3�ۣ�������1mol NH3ʱת�Ƶĵ�����Ϊ___________��
��4��H2O2����Ϊ��ɫ��������������_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�Al��OH��3����ã�������
A.Al2O3��ϡ����
B.Al2O3��ˮ
C.Al2��SO4��3��KOH
D.AlCl3�Ͱ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���Ҫ�ɷ�ΪMnO2����������������ͭ�����Ļ�����Ʊ�MnSO4���Һ�̶���ȡ�̵Ĺ�ҵ��������
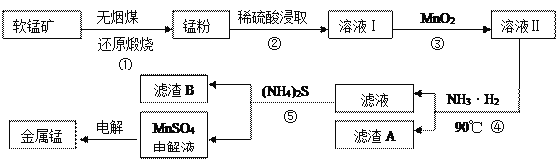
��1����֪�̷۵���Ҫ�ɷ�ΪMnO����Ӧ�ٵĻ�ѧ����ʽΪ________________________��
��2��ʵ���ҿ������̿���Ũ���ᷴӦ��Cl2���Ƚ�MnO2��C12��Fe3+��������ǿ����_______��
��3����ҺI�м���һ��������MnO2�ԲⶨFe2+��Ũ�ȣ�����MnO2�йط�Ӧ�����ӷ���ʽΪ___________________________________________________________________��
��4����֪90��ʱˮ�����ӻ�����Kw=3��6��10��13��Fe(OH)3��Ksp=6��4��10��25��Ҫʹ����A������ȫ�����ð�ˮ��pH����Ϊ______����֪lg 3��0��5����
��5����Һ������Ҫ�ɷ�Ϊ ____________������B����Ҫ�ɷ�Ϊ_________________��
��6����ҵ���ö��������Ʊ�������أ����ö��������Ƶ�����أ����ö��Ե缫����������Һ�õ�������أ����ʱ������ӦʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A. ��״���£�22.4 L 14CO2��44 g 14CO2����������ΪNA
B. 1 mol CH3COOH������CH3CH2OH��Ũ��������¹�������NA��������������
C. �����£�pH=13��NaOH��Һ�к�OH-������Ϊ0.1 NA
D. Ũ��Ϊ2 mol/L��FeCl3��Һ500 mLˮ�������Fe(OH)3����������ĿС��NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʒ�Ӧѡ�õ������ǣ� ��
A.�մ�����B.ʯӢ����
C.��ͨ��������D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ʷ�����ѧ��Ӧʱ�������������仯
B.���ȷ�Ӧһ��Ҫ�ڼ��Ȼ���������²��ܽ���
C.Ũ��������ˮʱ���۽����Ѳ��ų��������ȣ����Ըù����Ƿ��ȷ�Ӧ
D.��ɫ��Ӧ�������仯��������ɫ��Ӧ�ǻ�ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��ͨ��ʵ���о�NO2�����ʡ�
��֪��2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O
������ͼ��ʾװ��̽��NO2�ܷ�NH3��ԭ��K1��K2Ϊֹˮ�����г̶ֹ�װ����ȥ����

��1��Eװ������ȡNO2��Ӧ�Ļ�ѧ����ʽ��________________________________��
��2����ȡ����ʱ��ֻ��һ���Լ��������й���������ѡȡ___________
a��NH4HCO3 b��NH4C1 c��Ca(OH)2 d��NaOH
��3����NO2�ܹ���NH3��ԭ��Ԥ�ڹ۲쵽Cװ���е�������____________________��
��4��ʵ����������������ã���δ�ܹ۲쵽Cװ���е�Ԥ������С��ͬѧ�ӷ�Ӧԭ���ĽǶȷ�����ԭ����Ϊ�����ǣ�
�� NH3��ԭ�Խ��������ܽ�NO2��ԭ���� �ڴ������£�NO2��ת���ʼ��ͣ�
��_______________________________________
��5����ʵ��װ�ô���һ�����Ե�ȱ����________________________
��6��Ϊ����֤NO2�ܱ�Na2O2��������С��ͬѧѡ��B��D��Eװ�ã���B�е�ҩƷ����ΪNa2O2����ѡFװ�ã�����ͼ��ʾ����������װ������ʵ�顣

�� װ�õĺ�������˳���� _____________
�� ʵ������У�Bװ���е���ɫ��ĩ��ɰ�ɫ�������飬�ð�ɫ����Ϊ��������������������ɡ��Ʋ�Bװ���з�Ӧ�Ļ�ѧ����ʽΪ____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com