
【题目】化学反应总是伴随能量变化,已知下列化学反应的焓变
①2HI(g)=H2(g)+I2(g)△H1
②SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)△H2
③H2SO4(l)=H2O(g)+SO2(g)+ ![]() O2(g)△H3
O2(g)△H3
④2H2O(g)=2H2(g)+O2(g)△H4
△H4与△H1、△H2、△H3之间的关系是:△H4= .
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成NH3的反应
C. 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物.
请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是(填元素名称),可以验证该结论的是(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)写出C、D两元素形成的原子个数比为1:1的化合物与E、C两元素形成的原子个数比为1:2的化合物反应的化学方程式: .
(3)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
(4)A和E,A和C可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为;
(5)B元素的气态氢化物和其一种常见氧化物(双原子分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为 .
(6)在火箭推进器中装有液态B2A4和液态A2C2 , 已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量.试写出该反应的热化学方程式: . B2A4的电子式
(7)A2C的沸点比A2E 沸点 , 原因是
(8)下列事实可以用氢键解释的是
A.水比硫化氢稳定.
B.氨气易液化.
C.氨气极易溶于水.
D.水结成冰,密度减小,体积增大.
(9)用电子式表示氯化氢的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 铜丝在氯气中燃烧,产生的是棕色的烟
B. 铁丝能代替铂丝来做焰色反应实验
C. 用苯代替四氯化碳萃取碘水时,两者的实验现象相同
D. 可以用pH试纸测定二氧化硫水溶液的pH值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于煤与石油化工的说法,正确的是( )
A. 煤焦油干馏可得到苯、甲苯等
B. 煤裂化可得到汽油、柴油、煤油等轻质油
C. 石油分馏可得到乙烯、丙烯等重要化工产品
D. 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
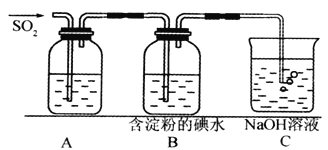
(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置A中的现象是__________________,写出B中发生反应的离子方程式:__________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。
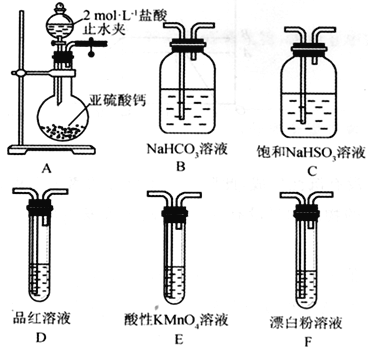
(4)装置正确的连接顺序为A、________________________________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_____________________________。
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是______________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A. 醋酸溶于水:CH3COOH===CH3COO-+H+
B. NaHSO4溶于水:NaHSO4===Na++HSO4-
C. 碳酸氢钠溶于水:NaHCO3![]() HCO
HCO![]() +Na+
+Na+
D. 次氯酸溶于水:HClO![]() H++ClO-
H++ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com