
【题目】全钒液流储能电池是一种新型的绿色环保储能系统(工作原理如图,电解液含硫酸)。该电池负载工作时,左罐颜色由黄色变为蓝色。

 4
4
下列说法错误的是
A.该电池工作原理为VO2++VO2++2H+![]() VO2++V3++H2O
VO2++V3++H2O
B.a和b接用电器时,左罐电动势小于右罐,电解液中的H+通过离子交换膜向左罐移动
C.电池储能时,电池负极溶液颜色变为紫色
D.电池无论是负载还是储能,每转移1 mol电子,均消耗1 mol氧化剂
【答案】B
【解析】
电池负载工作时,左罐顔色由黄色变为蓝色,说明ⅤO2+变为ⅤO2+,V化合价降低,则左罐所连电极a为正极;右罐发生V2+变为V3+,化合价升高的反应,所以右罐所连电极b为负极,因此电池反应为VO2++V2++2H+=VO2++V3++H2O,所以,该储能电池工作原理为VO2++VO2++2H+![]() VO2++V3++H2O,故A正确;
VO2++V3++H2O,故A正确;
B、a和b接用电器时,该装置为原电池,左罐所连电极为正极,所以电动势大于右罐,电解液中的H+通过离子交换膜向正极移动,即向左罐方向移动,故B错误;
C、电池储能时为电解池,故电池a极接电源正极,电池b极接电源负极,电池负极所处溶液即右罐V3+变为V2+,因此溶液颜色由绿色变为紫色,故C正确;
D、负载时为原电池,储能时为电解池,根据反应式VO2++VO2++2H+![]() VO2++V3++H2O可知,原电池时氧化剂为VO2+,电解池时氧化剂为V3+,它们与电子转移比例为n(VO2+):n(V3+):n(e-)=1:1:1,故D正确。
VO2++V3++H2O可知,原电池时氧化剂为VO2+,电解池时氧化剂为V3+,它们与电子转移比例为n(VO2+):n(V3+):n(e-)=1:1:1,故D正确。
答案选B。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热稳定系数和总氯量是漂白粉行业标准里的两个指标。
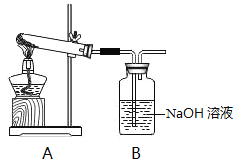
Ⅰ.利用如图装置,探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。
(1)加热干燥的漂白粉样品,观察到B中只有大量无色气泡产生,则次氯酸钙分解的固体产物中一定有_______________(填化学式)。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。B中发生反应的离子方程式为________________。
Ⅱ.测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值),实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,配制成500 mL溶液。
②移取25.00 mL该试样溶液至锥形瓶中,调节溶液pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000 mol·L-1AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液的平均体积为25.00 mL。〔已知:Ksp (AgCl,白色)=1.56×10-10,Ksp (Ag2CrO4,砖红色)=9.0×10-12〕
(3)步骤①溶液配制中,所用的玻璃仪器有烧杯、玻璃棒、________、________。
(4)加入H2O2溶液,搅拌至不再产生气泡,目的是__________(用离子方程式表示)。
(5)滴定终点的现象是___________________________。
(6)该漂白粉总氯的百分含量为______________。
(7)下列操作会导致总氯百分含量测定结果偏高的是__________(填序号)。
A.指示剂K2CrO4的用量过多
B.在达到滴定终点读数时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若平衡浓度符合下列关系式:![]() ,则此时的温度为1 000 °C
,则此时的温度为1 000 °C
D.在1L的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830°C,此时测得CO为0.4 mol,则该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种食品的配料标签如图所示:

(1)该配料中,富含糖类的物质是_________,富含蛋白质的物质是_________,富含油脂的物质是________;
(2)该配料中的________有防腐作用。碳酸氢钠受热分解,产生的气体使食品膨松,该过程的化学方程式为____________;
(3)用于包装该食品的聚乙烯塑料包装属于_________(填字母);
a.有机高分子材料 b.无机非金属材料 c.金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究补铁口服液中铁元素的价态,并测定该补铁口服液中铁元素的含量是否达标。
![]()
(1)实验一:探究补铁口服液中铁元素的价态。
甲同学:取1 mL补铁口服液,加入K3[Fe(CN)6](铁氰化钾)溶液,生成蓝色沉淀,证明该补铁口服液中铁元素以Fe2+形式存在。
乙同学:取5 mL补铁口服液,滴入10滴KSCN溶液无现象,再滴入10滴双氧水,未见到红色。乙同学为分析没有出现红色实验现象的原因,将上述溶液平均分为3份进行探究:
原因 | 实验操作及现象 | 结论 | ||
1 | 其他原料影响 | 乙同学观察该补铁口服液的配料表,发现其中有维生素C,维生素C有还原性,其作用是①______ | 取第1份溶液,继续滴入足量的双氧水,仍未见红色出现 | 排除②_________影响 |
2 | 量的原因 | 所加③________溶液(写化学式)太少,二者没有达到反应浓度 | 取第2份溶液,继续滴加该溶液至足量,仍然未出现红色 | 说明不是该溶液量少的影响 |
3 | 存在形式 | 铁的价态是+3价,但可能不是以自由离子Fe3+形式存在 | 取第3份溶液,滴加1滴稀硫酸,溶液迅速变为红色 | 说明Fe3+以④_______形式存在,用化学方程式结合文字,说明加酸后迅速显红色的原因 |
(2)甲同学注意到乙同学加稀硫酸变红后的溶液,放置一段时间后颜色又变浅了,他分析了SCN-中各元素的化合价,然后将变浅后的溶液分为两等份:一份中滴人KSCN溶液,发现红色又变深;另一份滴入双氧水,发现红色变得更浅,但无沉淀,也无刺激性气味的气体生成。根据实验现象,用离子方程式表示放置后溶液颜色变浅的原因________。
(3)实验二:测量补铁口服液中铁元素的含量是否达标。
该补铁口服液标签注明:本品含硫酸亚铁(FeSO4·7H2O)应为375~425(mg/100 mL),该实验小组设计如下实验,测定其中铁元素的含量。(说明:该实验中维生素C的影响已排除,不需要考虑维生素C消耗的酸性KMnO4溶液)
①取该补铁口服液100 mL,分成四等份,分别放入锥形瓶中,并分别加入少量稀硫酸振荡;
②向 ________式滴定管中加入0.002 mol.L-l酸性KMnO4溶液,并记录初始体积;
③滴定,直至溶液恰好_____________且30秒内不褪色,记录末体积;
④重复实验。根据数据计算,平均消耗酸性KMnO4溶液的体积为35.00 mL。计算每100 mL该补铁口服液中含铁元素__________mg(以FeSO4·7H2O的质量计算),判断该补铁口服液中铁元素含量___________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2 ![]() Cu(OH)2
Cu(OH)2 ![]() Cu
Cu
C.Al ![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D.MgO(s)![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 分子式为C4H8有机物最多存在4个C﹣C单键
B. ![]() 和
和![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个﹣CH2﹣,因此是同系物关系
分子组成相差一个﹣CH2﹣,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C﹣H键和C﹣O键的振动吸收,由此可以初步推测有机物结构简式为C2H5﹣OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com