
【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)
【答案】 增大固体接触面积,使反应更充分 GeS2+3O2![]() GeO2+2SO2 4NaH2PO2 +8GeO2
GeO2+2SO2 4NaH2PO2 +8GeO2![]() Na4P2O7+H2O+8GeO↑+2H3PO4 20-25 当CaCl2/Ge质量比位于20-25时,锗的沉淀率最大 bd > NaHGeO3的水解平衡常数Kh=Kw/Ka1=1×10-14/1.7×10-9=1/1.7×10-5>Ka2=1.9×10-13 ,即NaHGeO3溶液中水解程度大于电离程度,溶液显碱性,故pH>7
Na4P2O7+H2O+8GeO↑+2H3PO4 20-25 当CaCl2/Ge质量比位于20-25时,锗的沉淀率最大 bd > NaHGeO3的水解平衡常数Kh=Kw/Ka1=1×10-14/1.7×10-9=1/1.7×10-5>Ka2=1.9×10-13 ,即NaHGeO3溶液中水解程度大于电离程度,溶液显碱性,故pH>7
【解析】分析:精硫锗矿(主要成分为GeS2,杂质不反应)粉碎后高温下焙烧生成SO2和GeO2。利用NaH2PO2将GeO2还原为GeO,在碱性溶液中双氧水把GeO氧化为Na2GeO3,利用氯化钙沉淀得到CaGeO3,最终得到Ge,据此解答。
分析:(1)开始将精硫锗矿粉碎的目的是增大固体接触面积,加快反应速率,使反应更充分。
(2)高温焙烧精硫锗矿生成SO2和GeO2,根据原子守恒和电子得失守恒可知反应的化学方程式为GeS2+3O2![]() GeO2+2SO2。
GeO2+2SO2。
(3)热还原真空挥发炉内NaH2PO2将GeO2还原为GeO,同时还有Na4P2O7、H2O、H3PO4生成,根据原子守恒可知反应的化学方程式为4NaH2PO2+8GeO2![]() Na4P2O7+H2O+8GeO↑+2H3PO4。
Na4P2O7+H2O+8GeO↑+2H3PO4。
(4)根据表中数据可知当CaCl2/Ge质量比位于20~25时,锗的沉淀率最大,因此选择最佳加料量为20~25。
(5)a.溶度积常数只与温度有关系,则n点与p点对应的Ksp相等,a正确;b.蒸发时溶液的体积减小,离子浓度均增大,所以通过蒸发不能使溶液由q点变到p点,b错误;c.q点位于溶解平衡曲线的下方,离子积常数小于溶度积常数,因此无CaGeO3沉淀生成,c正确;d.加入Na2GeO3有沉淀析出,钙离子浓度减小,因此不能使溶液由n点变到m点,d错误,答案选bd;
(6)NaHGeO3的水解平衡常数Kh=Kw/Ka1=1×10-14/1.7×10-9=1/1.7×10-5>Ka2=1.9×10-13,这说明NaHGeO3溶液中HGeO3-的水解程度大于电离程度,溶液显碱性,因此pH>7。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,向2.24L密闭容器中充满NO2气体,其所含分子数为0.1 NA
B. CuO和Cu2S的混合物80 g中,所含铜粒子数为2NA
C. 常温常压下,22gT2O含中子数为12NA
D. 1.0 L 1.0 mol·L-1的NaNO3水溶液中含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于镁合金具有硬度大、密度小、散热性好、抗震性好等优异性能它被用于制笔记本电脑外壳、竞赛自行车车架等。现称取一定质量的镁铝合金样品放入500 mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。

(1)合金中Al的质量为__________________。
(2)NaOH溶液的物质的量浓度为__________________。
(3)稀硫酸的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.萃取操作可在普通漏斗中完成
B.浓烧碱液沾到皮肤上应立即用稀盐酸冲洗
C.闻未知液体或气体的气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动
D.用容量瓶配制好一定浓度的某溶液后,将溶液保存在容量瓶中并贴上标签
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为__________。氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)根据等电子体原理,在NO中氮原子轨道杂化类型是__________;1 mol O![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为__________。
(4)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子?__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:
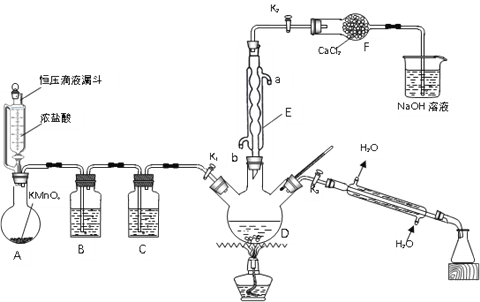
回答下列问题:
(1)仪器E的名称是______;其作用是______;其进水口为______(填“a”或“b”)。
(2)装置B中的溶液为______;装置F的作用是______。
(3)用恒压滴液漏斗代替分液漏斗的优点是______。
(4)装置A中反应的离子方程式为______。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为______%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A的焰色为黄色;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射,生成黑色固体。
根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)写出下列化学方程式:
①A在空气中燃烧_______________________________________;
②B与AgNO3 溶液:_________________________________;
③C与氢氧化钠溶液:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________。
(2)浓盐酸在该反应中表现了____________(选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______mol HCl被氧化,产生的Cl2在标准状况下的体积为__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com