
【题目】有A、B、C、D四种常见的金属单质,A的焰色为黄色;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射,生成黑色固体。
根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)写出下列化学方程式:
①A在空气中燃烧_______________________________________;
②B与AgNO3 溶液:_________________________________;
③C与氢氧化钠溶液:___________________________________________。
【答案】Na Cu Al Fe 2Na+O2![]() Na2O2 Cu+2AgNO3=Cu(NO3)2+2Ag 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
Na2O2 Cu+2AgNO3=Cu(NO3)2+2Ag 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
【解析】
有A、B、C、D四种常见的金属单质,A的焰色为黄色,则A为Na单质;B为红色固体,锈蚀时变为绿色,则B为Cu单质;C在空气中加热熔化但不滴落,C的熔沸点相对较低,因表面的氧化膜熔点较高,使融化的单质无法滴落,则C为Al单质;D在氧气中燃烧,火星四射,生成黑色固体,为Fe。
根据分析可知,
(1)对应化学式:A为Na;B为Cu;C为Al;D为Fe;
(2)本关反应的化学方程式如下:
①Na在空气中燃烧生成过氧化钠,方程式为2Na+O2![]() Na2O2;
Na2O2;
②Cu与AgNO3发生置换反应生成硝酸铜和单质Ag: Cu+2AgNO3=Cu(NO3)2+2Ag;
③Al与氢氧化钠溶液反应生成偏铝酸钠和氢气:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“双桥法”表示下列氧化还原反应中电子转移的方向和数目,并指出氧化剂和还原剂。2KClO3 === 2KCl+3O2↑ _______氧化剂_____ 还原剂_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
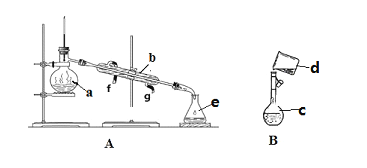
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/LNaOH滴定25.00 mL 0.1000 mol/L某一元酸HX,滴定过程中pH变化曲线如图所示。下列说法正确的是 ( )

A. 滴定前,酸中c(H+)等于碱中c(OH-)
B. 在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点,c(X-)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com