
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A.SiO2和SO2 B.NaCl和HCl
C.CO2和H2O D.CH4和KCl
科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是

A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B. 的正、逆反应的平衡常数K随温度的变化可用上图表示
的正、逆反应的平衡常数K随温度的变化可用上图表示
C. ,常温下该反应一定能自发进行
,常温下该反应一定能自发进行
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分,请都用字母序号填写,多选、错选均不得分)有下列几种晶体:
A.SiC
B.CO2
C.水晶
D.白磷
E.晶体氩
F.氯化铵
G.金刚石
H.铁
(1)其中经常用作玻璃刀刀头的是
(2)属于原子晶体的化合物是________________________
(3)含有共价键的离子晶体是_________________________
(4)受热熔化后化学键不发生变化的是_________________
(5)熔融状态下能导电的是___________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知C3N4晶体的硬度很可能比金刚石还大,且原子间均以单键结合,下列关于C3N4的说法正确的是

A.C3N4可能是分子晶体
B.C3N4晶体中C—N键的键长比金刚石的C—C键的键长要长
C.C3N4晶体是每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以非极性键形成空间的网状结构
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:填空题
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。

①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
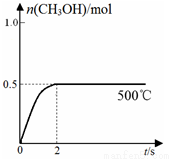
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是
X | Y | ||
Z | W | Q |
A.X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1∶2
B.含X和Z元素的常见化合物为分子晶体
C.氧化物对应的水化物酸性:W<Q
D.原子半径大小关系:Q>W>Z>Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
(15分)研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
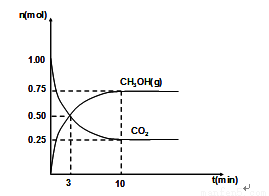
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
A、使用更有效的催化剂
B、在原容器中再充入1mol CO2
C、在原容器中再充入1mol He
D、缩小容器的体积
E、将甲醇及时分离出来
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
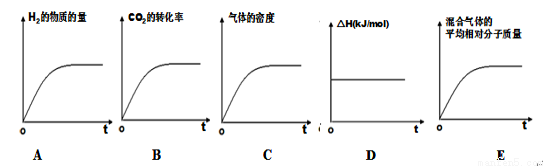
④该条件下,此反应的化学平衡常数为 。
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
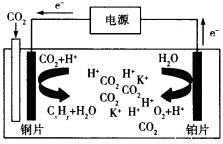
(4)已知
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN- —2e- +2OH- ═CNO- +H2O
②2Cl- 一2e══Cl2 ↑
③3Cl2 +2CNO- +8OH-═N2 +6Cl-十2CO32-+4H2O
下列说法正确的是

A.铁电极上发生的反应为Fe一2e一═Fe2+
B.通电过程中溶液pH不断增大
C.为了使电解池连续工作,需要不断补充NaCl
D.除去1 mol CN-,外电路至少需转移5 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com