
【题目】某废催化剂含ZnO、ZnS、CuS和SiO2及少量的Fe3O4。
I.某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
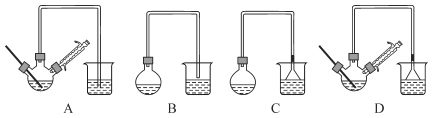
(1)在下图装置中,第一次浸出反应装置最合理的是____(填标号)。步骤①中发生的化学反应为非氧化还原反应,最好在(填设备名称)____中进行。
(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法为(提供的试剂:K3[Fe(CN)6]溶液、稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)____。
(3)步骤③中发生反应的离子方程式为____;向盛有滤渣1的反应器中加入稀硫酸和过氧化氢溶液,应先加____,若顺序相反,会造成____。
(4)步骤②、④中,获得晶体的实验操作方法是____,过滤。
Ⅱ.另一同学也以该废催化剂为原料,采用下列实验操作方法也得到了ZnSO4。
![]()
(5)若一次水解时,产物为Zn( OH)xCly。取一次水解产物10. 64 g,经二次水解、干燥,得到9.9 g的Zn(OH)2(假设各步均转化完全),则一次水解产物的化学式为_______ .
【答案】C 通风橱 取少量滤液1,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明有Fe2+(或滴加KMnO4溶液,若褪色则证明有Fe2+) CuS+H2O2+2H+![]() Cu2++S+2H2O 稀硫酸 H2O2与固体颗粒接触分解 蒸发浓缩、冷却结晶 Zn(OH)1.6Cl0.4
Cu2++S+2H2O 稀硫酸 H2O2与固体颗粒接触分解 蒸发浓缩、冷却结晶 Zn(OH)1.6Cl0.4
【解析】
废催化剂中含ZnO、ZnS、CuS、SiO2、Fe3O4,加入硫酸,ZnO、ZnS、Fe3O4与稀硫酸反应,滤液1中含有Zn2+、Fe2+、Fe3+,CuS、SiO2不与稀硫酸发生反应,即滤渣1中有SiO2、CuS,滤渣1中加入稀硫酸和H2O2加热浸出CuSO4;然后逐项进行分析;
(1)①中发生ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑、Fe3O4+8H+=Fe2++2Fe3++4H2O,这些反应不需要加热,因此反应装置中不需要温度计,H2S有毒,能溶于水,尾气处理时,需要防止倒吸,即C装置最合理;发生反应时,产生H2S气体,H2S气体有毒,且易燃,需要在通风厨中进行;
(2)根据(1)的分析,滤液1中含有Zn2+、Fe2+、Fe3+,检验Fe2+用K3[Fe(CN)6]或高锰酸钾溶液,具体操作是取少量滤液1,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明有Fe2+或滴加KMnO4溶液,若褪色则证明有Fe2+;
(3)滤渣1为CuS和SiO2,SiO2不与稀硫酸、H2O2发生反应,CuS中S显-2价具有还原性,能被H2O2氧化,发生的离子方程式为CuS+H2O2+2H+![]() Cu2++S+2H2O;向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,会造成H2O2与固体颗粒接触分解;
Cu2++S+2H2O;向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,会造成H2O2与固体颗粒接触分解;
(4)获得晶体中含有结晶水,因此实验操作方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)根据锌原子守恒,Zn(OH)xCly的物质的量为![]() =0.1mol,Zn(OH)xCly的摩尔质量为
=0.1mol,Zn(OH)xCly的摩尔质量为![]() =106.4g/mol,则有65+17x+35.5y=106.4,根据化合价代数和为0,则有x+y=2,两式联立解得x=1.6,y=0.4,化学式为Zn(OH)1.6Cl0.4。
=106.4g/mol,则有65+17x+35.5y=106.4,根据化合价代数和为0,则有x+y=2,两式联立解得x=1.6,y=0.4,化学式为Zn(OH)1.6Cl0.4。


科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.CO2通入饱和碳酸钠溶液中:CO2 +CO32- + H2O=2HCO3-
B.明矾溶液中加氢氧化钡至硫酸根恰好沉淀完全:Al3+ + 2SO42- + 2Ba2+ + 4OH- == 2BaSO4↓ + AlO2- + 2H2O
C.钠和冷水反应Na+ 2H2O =Na+ + 2OH- + H2↑
D.氯化铝溶液中加入过量的氨水Al3+ + 4NH3·H2O =AlO2- + 4NH4+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制0.500 mol/L的Na2CO3溶液100mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、__________、_______.
(2)本实验须称量碳酸钠晶体(Na2CO310H2O)________g。
(3)①如果定容时仰视会导致溶液浓度__________(填“偏高”、“偏低”或“无影响” 下同);
②容量瓶未经干燥就用来配制该溶液,会导致溶液浓度_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知: ,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
,且A→B为加成反应,则B的结构简式是______________;B→C的反应类型是____________。
II.叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成。
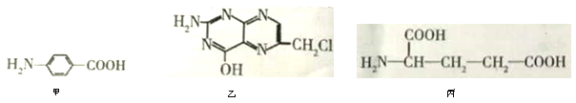
(1)甲中显酸性的官能团是______________(填名称)。
(2)下列关于乙的说法正确的是__________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,了的结构简式为______________.
a.含有![]() b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,也是化学实验室里必备的重要试剂。除了具有酸的通性以外,还具有一些特殊的性质。
Ⅰ.镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目___。
(2)该反应中氧化剂与还原剂的物质的量之比为___。
(3)还原产物是__。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为__。
Ⅱ.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应的产物之一。写出反应的化学方程式__(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)磷酸钠(Na3PO4)在水溶液中的电离方程式为__ 。
(2)镁条在氮气中燃烧的化学方程式为___。
(3)过氧化钠与水反应的化学方程式为___。该反应中,氧化剂是___,还原剂是___。
(4)浓硫酸和碳在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com